
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

РН буферных растворов.
|
|
Для буферной системы I типа НА/A- концентрацию ионов Н+ в растворе легко вычислить, исходя из константы диссоциации слабой кислоты (для простоты изложения вместо активностей ионов в выражении для  будем использовать их концентрации):
будем использовать их концентрации):
НA ⇄ A- + H+;
 , ,
|
отсюда:
 . .
|
В присутствии второго компонента буферного раствора – сильного электролита – равновесие диссоциации слабой кислоты НA, согласно принципу Ле-Шателье, смещено влево. Поэтому можно считать, что концентрация недиссоциированных молекул НA практически равна концентрации кислоты в буферном растворе, а концентрация ионов A- равна концентрации соли.
В таком случае можно записать:
 , ,
| (3) |
где С(кислоты) и С(соли) – молярные концентрации кислоты и соли.
Если равенство (3) прологарифмировать (взять отрицательный десятичный логарифм левой и правой частей уравнения), то получим:
 . .
| (4) |
Так, рН фосфатной буферной системы состава NaH2PO4/Na2HPO4 можно рассчитать по уравнению:
 , ,
|
где  – показатель константы диссоциации фосфорной кислоты по второй ступени.
– показатель константы диссоциации фосфорной кислоты по второй ступени.
В случаях, когда требуется получить буферный раствор с задан-ным значением pH, используют уравнение:
 , ,
| (5) |
где индексом «0» обозначены характеристики исходных растворов кислоты и соли, смешиванием которых получают требуемую буферную смесь.
Для буферной системы II типа В/ВН+, например аммонийной, гидроксидный и водородный показатели вычисляют по уравнениям:
 , ,
| (6) |
 , ,
| (6¢) |
где  – показатель константы диссоциации основания.
– показатель константы диссоциации основания.
В общем виде уравнение для расчета pH буферных систем выглядит следующим образом:
 , ,
| (7) |
и называется уравнением Гендерсона-Гассельбаха.
Из уравнения Гендерсона-Гассельбаха следует, что:
1. Величина рН буферных растворов зависит от константы диссоциации кислоты или основания и от соотношения количеств компонентов, но практически не зависит от разбавления или концентрирования растворов. Действительно, в этих процессах концентрации компонентов буферного раствора изменяются пропорционально, поэтому их соотношение, которое определяет значение рН буферного раствора, остается неизменным.
Если концентрации компонентов буферных растворов превышают 0,1 моль/л, то в расчетах необходимо учитывать коэффициенты активности ионов системы.
2. Показатель константы диссоциации слабого электролита определяет область буферного действия раствора, т.е. тот интервал значений водородного показателя, в котором сохраняются буферные свойства системы. Поскольку буферное действие продолжается, пока не израсходовано 90% компонента (т.е. его концентрация не уменьшилась на порядок), то область (зона) буферного действия отличается от  на 1 единицу:
на 1 единицу:
 ;
;
 .
.
Амфолиты могут иметь несколько зон буферного действия, каждая из которых отвечает соответствующей константе  :
:
 .
.
Таким образом, максимально допустимое соотношение компонентов раствора, при котором он проявляет буферное действие, составляет 10:1.
Пример 1. Можно ли приготовить ацетатный буфер с рН = 6,5, если  уксусной кислоты равен 4,74?
уксусной кислоты равен 4,74?
Решение.
Поскольку зона буферного действия определяется как  , для ацетатного буфера она находится в интервале значений рН от 3,74 до 5,74. Значение рН = 6,5 лежит за пределами зоны действия ацетатного буфера, поэтому на основе ацетатной буферной системы такой буфер приготовить нельзя.
, для ацетатного буфера она находится в интервале значений рН от 3,74 до 5,74. Значение рН = 6,5 лежит за пределами зоны действия ацетатного буфера, поэтому на основе ацетатной буферной системы такой буфер приготовить нельзя.
Пример 2. Вычислить рН буферного раствора, в 100 мл которого содержится 1,2 г уксусной кислоты и 5,88 г ацетата калия, если для уксусной кислоты  = 4,74.
= 4,74.
Решение.
Молярные концентрации кислоты и соли в буферном растворе равны:
 ;
;
 .
.
Подставив эти значения в уравнение (7), получим:

Пример 3 Рассчитать рН буферной смеси, если для ее приготовления были взяты растворы муравьиной кислоты и формиата натрия одинаковой молярной концентрации в соотношении 7:3.  (НСООН) = 1,8×10-4.
(НСООН) = 1,8×10-4.
Решение.
Так как молярные концентрации кислоты и соли равны, то при расчете pH по формуле (5) можно использовать только объемное соотношение компонентов:

Пример 4. Рассчитать значение pH буферного раствора, полученного при сливании 20 мл раствора аммиачной воды с С(NH3·H2O) = 0,02 моль/л и 10 мл раствора хлорида аммония с С(NH4Cl) = 0,01 моль/л.  (NH3·H2O) = 1,8·10−5. Найти рН буфера, разбавленного в 5 раз.
(NH3·H2O) = 1,8·10−5. Найти рН буфера, разбавленного в 5 раз.
Решение.
В случае буферной системы II типа pH раствора рассчитывают по уравнению (6¢):
 .
.
Подставив соответствующие значения, получим:
 .
.
При разбавлении рН буферных растворов не изменяется. Следовательно, рН буферного раствора, разбавленного в 5 раз, будет равен 9,86.
Пример 5. Буферный раствор получен сливанием 100 мл раствора СН3СООН с С(СН3СООН) = 0,02 моль/л и 50 мл раствора CH3COONa с С(CH3COONa) = 0,01 моль/л.  (СН3СООН) = 1,8×10-5. Рассчитать:
(СН3СООН) = 1,8×10-5. Рассчитать:
а) рН полученного буфера;
б) изменение рН буфера при добавлении 5 мл раствора HCl c C(HCl) = 0,01 моль/л.
в) буферную емкость раствора по щелочи.
Решение.
Для расчета рН полученного буфера воспользуемся формулой (5):

При добавлении кислоты протекает реакция:
СН3СОONa + HCl  CH3COOH + NaCl,
CH3COOH + NaCl,
в результате которой изменяются количества компонентов буферной системы.
С учетом соотношения n(x) = C(x)×V(x) уравнение (7) может быть представлено в виде:
 .
.
Так как количества прореагировавших и образовавшихся веществ равны, то изменение количеств кислоты и соли в буферном растворе составит одну и туже величину x:
 ,
,
 .
.
В исходной буферной смеси количества компонентов составляют:
 ;
;
 .
.
Найдем величину x:
 .
.
Отсюда:
 .
.
Таким образом, разность значений рН составит  , т.е. изменение рН пренебрежимо мало.
, т.е. изменение рН пренебрежимо мало.
Буферная емкость.
Прибавлять кислоту или щелочь, существенно не меняя рН буферного раствора, можно лишь в относительно небольших количествах, так как способность буферных растворов сохранять постоянство рН ограничена.
Величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочей, называется буферной емкостью (В). Различают буферную емкость по кислоте ( ) и по щелочи (
) и по щелочи ( ).
).
Буферная емкость (В) измеряется количеством кислоты или щелочи (моль или ммоль эквивалента), добавление которого к 1 л буферного раствора изменяет рН на единицу.
На практике буферную емкость определяют титрованием. Для этого определенный объем буферного раствора титруют сильной кислотой или щелочью известной концентрации до достижения точки эквивалентности. Титрование проводят в присутствии кислотно-основных индикаторов, при правильном выборе которых фиксируют состояние, когда компонент буферной системы прореагирует полностью. По полученным результатам рассчитывают величину буферной емкости ( или
или  ):
):

| (8) |
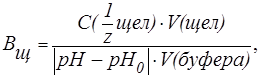
| (9) |
где С(  к-ты), С(
к-ты), С(  щел) - молярные концентрации эквивалента кислоты и щелочи (моль/л);
щел) - молярные концентрации эквивалента кислоты и щелочи (моль/л);
V(к-ты), V(щел) - объемы добавленных растворов кислоты или щелочи (л; мл);
V(буфера) - объем буферного раствора (л; мл);
pH0 и pH - значения рН буферного раствора до и после титрования кислотой или щелочью (изменение рН берется по абсолютной величине).
Буферную емкость выражают в [моль/л] или в [ммоль/л].
Буферная емкость зависит от ряда факторов:
1. Чем больше абсолютное содержание компонентов пары основание/сопряженная кислота, тем выше буферная емкость буферного раствора.
Буферная емкость зависит от соотношения количеств компонентов буферного раствора, а следовательно, и от рН буфера. Буферная емкость максимальна при равных количествах компонентов буферной системы и уменьшается с отклонением от этого соотношения.
3. При различном содержании компонентов буферные емкости раствора по кислоте и по щелочи отличаются. Так, в буферном растворе I типа чем больше содержание кислоты, тем больше буферная емкость по щелочи, а чем больше содержание соли, тем больше буферная емкость по кислоте. В буферном растворе II типа чем больше содержание соли, тем больше буферная емкость по щелочи, а чем больше содержание основания, тем больше буферная емкость по кислоте.
Пример 2. Для приготовления ацетатных буферных смесей растворы кислоты и соли одинаковой молярной концентрации были смешаны в следующих объемных соотношениях:
| Состав буферной системы | Объемные соотношения компонентов буферной системы | ||
| раствор I | раствор II | раствор III | |
| CH3COOH | |||
| CH3COONa |
Не прибегая к расчетам, определить, в каком из трёх буферных растворов будет наблюдаться:
а) наибольшее значение рН;
б) максимальная буферная емкость;
в) наибольшая буферная емкость по кислоте.
Решение.
В случае равных концентраций компонентов уравнение (5) принимает вид:
 .
.
Так как  во всех трех растворах одинакова, то значение pH буфера будет определяться соотношением
во всех трех растворах одинакова, то значение pH буфера будет определяться соотношением  . Следовательно, наибольшим значением pH будет обладать I раствор (
. Следовательно, наибольшим значением pH будет обладать I раствор ( ):
):

Максимальной буферной емкостью характеризуется II раствор, так как в нем соотношение количеств компонентов составляет 1:1.
Буферная емкость по кислоте для ацетатного буфера определя-ется содержанием сопряженного основания, т.е. соли: чем оно больше, тем больше буферная емкость раствора по кислоте. Поэтому:

Таким образом, наибольшую емкость по кислоте будет иметь I раствор.
Date: 2016-11-17; view: 2905; Нарушение авторских прав