
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Типы буферных систем
|
|
Буферные системы (буферы) – это равновесные системы, способные поддерживать постоянство рН при разбавлении раствора или при добавлении к нему некоторого количества сильной кислоты или щелочи. Эта способность буферных систем называется буферным действием. Растворы, содержащие одну или несколько буферных систем называются буферными растворами. Интервал значений рН, в котором система проявляет буферные свойства, называется зоной буферного действия.
Буферные растворы применяются для сохранения активной реакции среды на определенном уровне, если тот или иной процесс (например, выращивание культуры бактерий, проведение ферментативной реакции и т.п.) должен быть проведен при постоянном значении рН.
Буферные системы могут быть двух типов. Некоторые примеры буферных систем и их характеристики приведены в таблице 1.
В биологических объектах буферные системы могут быть также образованы из ионов и молекул амфолитов, например, аминокислотные и белковые буферные системы.
В водных растворах a-аминокислоты присутствуют в виде равновесной смеси биполярного иона, катионной и анионной форм:

Таблица 1. Типы буферных систем.
| I. Слабая кислота и ее анион НА/А- | |||
| Название | Состав | Протолитическое равновесие | Зона буферного действия |
| Ацетатная | СН3СООН и CH3COONa | СН3СООН ⇄ CH3COO- + H+ | рН = 3,8 - 5,8 |
| Гидрокарбонатная | Н2СО3 и NaНСО3 | Н2СО3 ⇄ НСО3- + H+ | рН = 5,4 - 7,4 |
| Фосфатная | NaH2PO4 и Na2HPO4 | H2PO4– ⇄ HPO42- + H+ | рН = 6,2 - 8,2 |
| Гемоглобиновая | HHb и KHb | HHb ⇄ Hb- + H+ | рН = 7,2 - 9,2 |
| Оксигемоглобиновая | HHbO2 и KHbO2 | HHbO2 ⇄ HbO2- + H+ | рН = 6,0 - 8,0 |
| II. Слабое основание и его катион В/ВН+ | |||
| Аммонийная | NH3×H2O и NH4Cl | NH3 + H+ ⇄ NH4+ | рН = 8,2 - 10,2 |
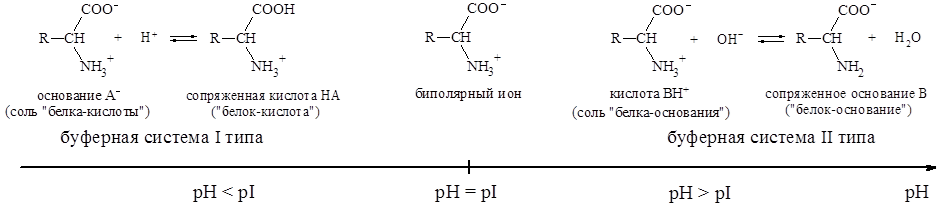 Рис.1. Буферные системы на основе амфолитов.
Рис.1. Буферные системы на основе амфолитов.
Соотношение между этими формами зависит от pH среды. В сильнокислых средах (pH = 1-2) преобладают катионные формы, в сильнощелочных (pH = 13-14) - анионные.
Полностью протонированная a-аминокислота (катионная форма), не содержащая ионогенных групп в радикале, с позиций теории Бренстеда является двухосновной кислотой, диссоциация которой описывается при помощи двух констант:  характеризует диссоциацию карбоксильной группы,
характеризует диссоциацию карбоксильной группы,  - протонированной аминогруппы.
- протонированной аминогруппы.
Значение pH, соответствующее наибольшей концентрации бипо-лярного иона, называется изоэлектрической точкой (pI). В общем случае величину pI вычисляют по формуле:
 , ,
| (1) |
где n - максимальное число положительных зарядов в полностью протонированной форме.
Для аминокислот, не содержащих ионогенных групп в радикале, величину pI вычисляют по формуле:

| (2) |
Пример 1. Рассчитать величину pI аргинина, если для этой a-аминокислоты: 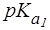 = 2,2;
= 2,2;  = 9,0;
= 9,0;  = 12,6.
= 12,6.
Решение.
Полностью протонированная форма аргинина выглядит так:
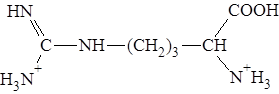
Видно, что n = 2. Поэтому:
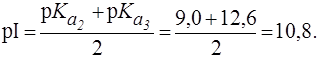
Растворы аминокислот с pH = pI не являются буферными. Они начинают проявлять буферное действие, когда к ним добавляют некоторое количество кислоты или щелочи. При этом образуется смесь двух форм белка - «белок-кислота» и «белок-основание» (рис.1). Из рис. 1. видно, что при pH < pI растворы белков и аминокислот могут проявлять свойства буферных систем I типа, а при pH > pI - II типа.
Date: 2016-11-17; view: 721; Нарушение авторских прав