
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Механизм буферного действия
|
|
С точки зрения протолитической теории буферное действие растворов обусловлено наличием кислотно-основного равновесия общего типа:
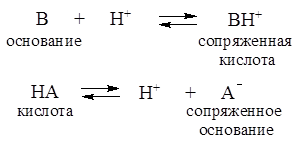
Сопряженные кислотно-основные пары А-/НА и В/ВН+ состав-ляют буферные системы.
Рассмотрим механизм буферного действия буферной системы на примере раствора, содержащего CH3COONa и СН3СООН. Уксусная кислота - слабый электролит, частично диссоциирующий на ионы:
СН3СООH ⇄ СН3СООН + H+
Ацетат натрия - сильный электролит, полностью распадающийся на ионы:
СН3СООNa  СН3СОО- + Na+
СН3СОО- + Na+
При добавлении сильной кислоты (например, НСl) сопряженное основание СН3СОО- связывает ионы Н+ в молекулы слабой кислоты:
СН3СОО- + H+  СН3СООН
СН3СООН
Таким образом, концентрация свободных ионов Н+ в растворе, а следовательно, и величина рН практически не изменяется.
Следует отметить, что при этом в буферной системе снижается концентрация анионов СН3СОО- и повышается концентрация моле-кул СН3СООН. В результате происходит небольшое изменение в соотношении концентраций слабой кислоты и ее соли и, как следст-вие, наблюдается незначительное изменение рН. Существенные отклонения значений pH (более чем на 1) наблюдаются в условиях практически полного (до 90%) расходования анионов СН3СОО-.
При добавлении сильной щелочи (например, КОН) усиливается диссоциация уксусной кислоты, поскольку выделяющиеся в раствор ионы Н+ реагируют с ионами ОН-, образуя воду:
СН3СООH + OH-  СН3СОО- + H2O
СН3СОО- + H2O
В этом случае также не происходит существенного изменения концентрации ионов Н+ в растворе, поскольку добавленные ионы ОН- оказываются связанными в молекулы слабого электролита - воды, но небольшое изменение в соотношении концентраций слабой кислоты и ее соли (уменьшение концентрации СН3СООН и увеличение концентрации СН3СОО-) приводит к незначительному повышению рН. Значительные отклонения значений pH (более чем на 1) наблюдаются в условиях практически полного (до 90%) расходования молекул кислоты.
Рассмотренные случаи показывают, что каждый компонент буферного раствора выполняет строго определенную функцию: за нейтрализацию добавленной кислоты «отвечают» анионы соли, а за нейтрализацию добавленной щелочи – молекулы кислоты.
Таким образом, для буферных растворов I типа справедливы заключения:
Date: 2016-11-17; view: 420; Нарушение авторских прав