
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основы молекулярно-кинетической теории
|
|
Молекулярная физика изучает строение и свойства вещества исходя из того, что любое тело – твердое, жидкое или газообразное – состоит из большого числа малых обособленных частиц – атомов или молекул.
Свойства тел, которые наблюдаются на опыте: температура, давление, объем объясняются как суммарный результат действия частиц.
Экспериментальным обоснованием молекулярно-кинетической теории является: а) броуновское движение;
б) диффузия; в) теплопроводность.
Эти явления можно объяснить только исходя из того, что вещества состоят из большого числа малых частиц, которые находятся в непрерывном хаотическом тепловом движении.
1) Закон А. Авогадро.
Отношение плотностей газов ρ1 и ρ2 при одинаковых условиях: 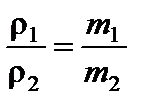 .
.
здесь 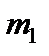 и
и 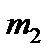 – массы молекул газов.
– массы молекул газов.
С другой стороны для одинаковых объемов:
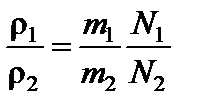 ,
,
здесь 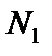 и
и 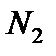 – число частиц газов
– число частиц газов
Из этих уравнений следует, что 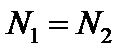 , т.е. при одинаковом давлении и температуре равные объёмы разных газов содержат одинаковое число частиц – это закон Авогадро.
, т.е. при одинаковом давлении и температуре равные объёмы разных газов содержат одинаковое число частиц – это закон Авогадро.
2) Закон Д. Дальтона. Закон Авогадро устанавливает, что давление газа зависит только от числа молекул в объёме, но не от того, какие это молекулы. Поэтому для смеси различных газов можно записать
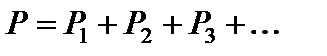 ,
,
здесь P – давление смеси газов, P 1 P 2 P 3 …. – парциальные давления каждого из газов, входящих в смесь.
Давление смеси газов равно сумме их парциальных давлений – закон Дальтона.
3) Масса и размеры молекул.
Относительной атомной массой Аr элемента называется отношение массы атома этого элемента к 1/12 массы атома изотопа углерода 12С с массовым числом 12.
Относительной молекулярной массой Мr называется отношение массы молекулы этого вещества к 1/12 массы атома 12С. 1/12 массы атома 12С называется атомной единицей массы (а.е.м.). 1а.е.м. = 1,66·10–27 кг.
Количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг изотопа углерода 12С, называется молем. Это число частиц называется числом Авогадро 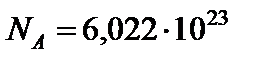 моль‑1.
моль‑1.
Массу одного моля называют молярной массой M. Очевидно, что: 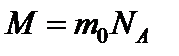
m 0 – масса молекулы вещества или атома элемента.
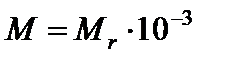 кг/моль;
кг/моль; 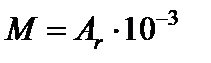 кг/моль.
кг/моль.
Найдем примерный размер молекулы. Моль воды имеет массу М = 18·10–3 кг; Объём моля 18·10–6 м3. Одна молекула занимает объём в NA раз меньший, то есть Vм ≈ 3·10‑30 м3, а ее линейный размер
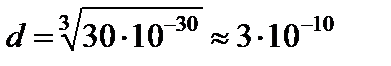 м
м
Молекулы других веществ имеют размеры того же порядка.
Date: 2016-05-25; view: 505; Нарушение авторских прав