
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Обсуждение и результаты
|
|
Циклические ацетали и кетали триолов, в частности глицерина, находят широкое применение в тонком органическом синтезе [64-66]. Недавно было показано, что некоторые соединения этого ряда могут быть использованы в качестве антифризных присадок к топливам [67,68], ПАВ [69], добавок в пищевой [70] и косметической [71] промышленности. В этой связи представляет интерес изучение строения циклических формалей глицерина и их производных. Ранее нами было показано, что О-алкилирование 4-гидроксиметил-2,2-диметил-1,3-диоксолана с количественным выходом приводит к соответствующим производным [72].
Целью настоящей работы являлось получение и определение строения эфиров и хлоридов на основе 4-гидроксиметил-1,3-диоксолана и 5-гидрокси-1,3-диоксана.
Синтез и структура циклических формалей глицерина
Исходные формали глицерина 1а,б получены конденсацией глицерина с формальдегидом в среде толуолаприТ=100°С в присутствии катионита КУ-2 в качестве катализатора с выходом 95% и соотношении 1а: 1б =1:3 (схема 2.1, табл. 2.1). Соотношение 1,3-диоксолан- и 1,3-диоксановых спиртов 1а и 1б определяли по интегральной интенсивности протонов находящихся при С-4 атоме в случае диоксолана 1а и С-5 – диоксана 1б (табл.2.2, приложение 2,3).
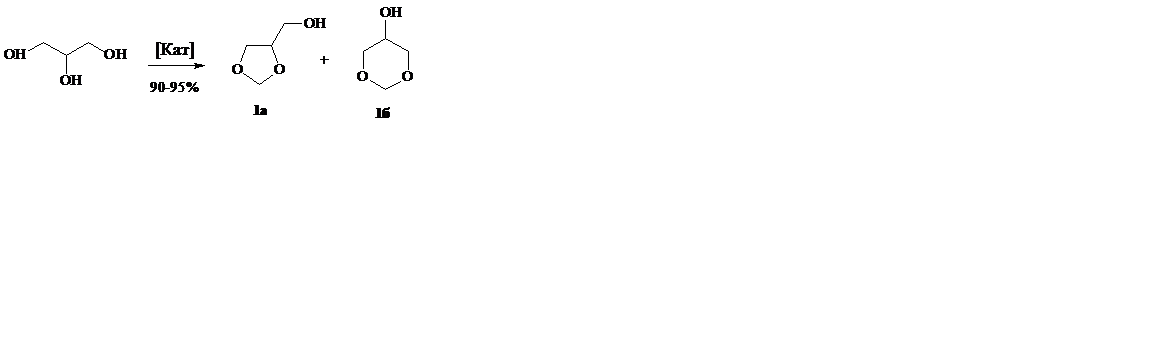
Реагенты и условия: a) HO(CH2O)nH (n ≈ 8—100), толуол, 100 °C, 6 ч;
Схема 2.1
Таблица 2.1. Влияние катализатора на общий выход, соотношение 1,3-диоксолан- и 1,3-диоксановых спиртов1а и 1б.
| Кат. | Выход* 1а+1б, (%) | Соотношение **1а: 1б | |
| КУ-2 | |||
| Н2SО4 | |||
| ТПСК |
*практический выход
**соотношение изомеров определено по спектрам ЯМР 1Н
Строение полученных циклических формалей глицерина 1а, б подтверждено данными ЯМР-спектроскопии 1Н, 13С (приложение рис. 1-3), в том числе с применением двумерных корреляционных методик (приложение рис. 4-6) и хромато-масc спектрометрии Отнесение сигналов замещенных гетероциклов 1а, б проведено на основании анализа величин химических сдвигов и КССВ протонов гетероциклического фрагмента (рис. 2.1,табл. 2.1, 2.2).

a

б
a - 4-гидроксиметил-1, 3-диоксолан; б - 5-гидрокси-1,3-диоксан.
Рисунок 2.1 - Отнесение сигналов замещенных гетероциклов смеси 4-гидроксиметил-1,3-диоксолана 1а и 5-гидрокси-1,3-диоксана 1б
Таблица 2.2- Данные спектров ЯМР 1Н (δ, м. д., J, Гц) соединений 4-гидроксиметил-1,3-диоксолана 1а и 5-гидрокси-1,3-диоксана 1б.
| соединение | Н(2) | Н(4) | Н(5) | Н(6) | R |
| 1а | 4.88 (с) 5.05 (с) | 4.17(м) | 3.64(м) 3.73(м) | 3.53(м) 3.62(м) | CH2OH:3.6(м, 3Н) |
| 1б | 4.78 (д, J 2 6.2), 4.90 (д, J2 6.2) | 3.72 (д.д, J2 11.4, J3 3.8) 3.85 (д.д, J2 11.4, J3 1.9) | 3.56 (т.т, J3 1.9, J3 3.8) | 3.72 (д.д, J2 11.4, J3 3.8) 3.85 (д.д, J2 11.4, J3 1.9) | OH: 3.6 уш. с. |
Таблица 2.2 - Данные спектров ЯМР 13С (δ, м. д., J, Гц) соединений 4-гидроксиметил-1,3-диоксолана 1а и 5-гидрокси-1,3-диоксана 1б
| соединение | С(2) | С(4) | С(5) | С(6) | R |
| 1а | 95.4 | 76.3 | 66.4 | 62.8 | CH2OH: 3.6 |
| 1б | 93.9 | 71.8 | 63. 8 | - | - |
В спектре ЯМР 1Н смеси 4-гидроксиметил-1,3-диоксолан 1а и 5-гидрокси-1,3-диоксана 1б синглетные сигналы при δH 4.88 и 5.05 м.д. (табл. 2.1) соответствуют протонам метиленовой группы при С(2) атоме диоксолана 1а, метиновые протоны при С(4) атоме диоксоланового кольца проявляются в виде триплета при δH 4.17 м.д. Эквивалентные протоны С(5)Н2-группы резонируют в области δH 3.64 и 3.73 м.д. в виде мультиплетов. Для диоксолана 1a протоны С(6) Н2- группы мультиплетов в области δH 3.53-3.62 м.д. и δH 3.6 (уш.с) соответствует протонам гидроксильной группы.
Для 1,3-диоксана 1б положение сигнала протона при δH 3.56 м.д. с КССВ 1.9 и 3.6 Гц в соответствует метиновому протону при С(5) атому и проявляется в виде триплет триплетов (табл. 2.1). Аномерные протоны при С(2) углеродном атоме диоксана 1б резонируют в области δН 4.78 и 4.90 м.д. в виде дублетов и имеют КССВ 6.2 и 6.2 Гц соответственно, что характерно для 5-замещенных 1,3-диоксанов. Аксиальные и экваториальные протоны метиленовой групп при С(4) атоме химически эквивалентны протонам при С(6) атоме. Сигналы Нах(4) и Нах(6) проявляются в более сильном поле δH и протоны Нeq(4) и Нeq (6) резонируют в области δH 3.72 и 3.85 м.д. в идее двух дублетов с одинаковой константой 11.4 Гц.
Отметим, что в 1,3-диоксане 1б, судя по положению сигналов протонов С5Н и ОН (3.56 м.д. и 3.60 м.д., соответственно), имеет место внутримолекулярная водородная связь за счет преимущественной аксиальной ориентации ОН-группы. Значение КССВ для протонов С5Н и С6Н диоксана 1б (2 J 11.4; 3 J 3.8 и 1.9 Гц) (табл.2.1) подтверждают экваториальное расположение протона и, соответственно, аксиальное положение ОН-группы при С(6) атоме. Полученные результаты согласуются с имеющимися литературными данными. Согласно которым, для цис -2-алкил-5-окси-1,3-диоксанов аналогичные значения химических сдвигов [73] близки (3.51 м.д. для экваториальной связи С5Н и 2.76 м.д. для аксиальной ОН-группы), тогда как сигнал экваториальной ОН-группы в транс -2-алкил-5-окси-1,3-диоксанах сдвинут в сильное поле (1.78 м.д.), а аксиальная ориентация С5Н-группы резонирует в слабом поле (3.86 м.д).
Как известно, образующиеся в результате взаимодействия триолов с карбонильными соединениями смесь диоксан- и диоксалановых спиртов находится в динамическом равновесии. В связи с этим, нами изучено влияние температуры, природы растворителя, рН-среды на смещение равновесия.
С использованием ЯМР спектроскопии было показано, что соотношение циклических формалей глицерина 1а, б не изменяется с течением времени. Так, в спектрах ЯМР 1Н смеси спиртов 1а, б записанных в CDCl3 при 25 С° через 1 час, сутки, неделю соотношение 1а: 1б не изменяется и остается равным 1: 3 (рис. 2.1).
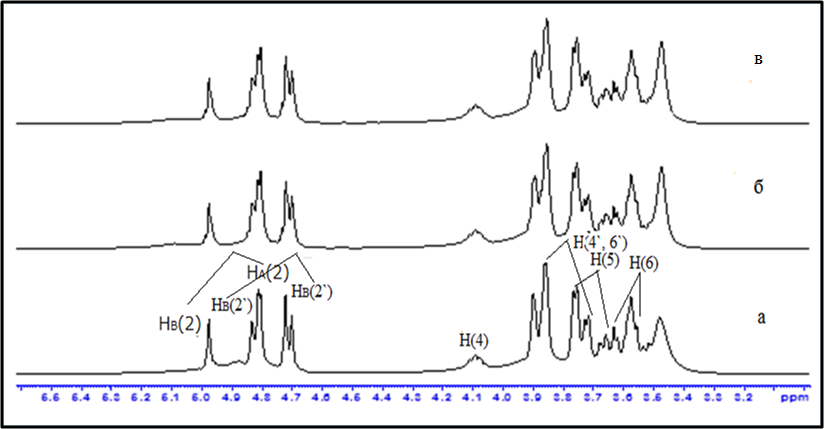
Рисунок 2.1. Фрагмент спектра ЯМР 1Н смеси 4-гидроксиметил-1,3-диоксолана 1а и 5-гидрокси-1,3-диоксана 1б во времени. а) через 1 час; б) через сутки; в) через неделю (СDCl3, 25°С, 300 МГц)
Природа растворителя может оказывать влияние на смещение динамического равновесия и на характер сигналов в спектрах ЯМР, и как следствие в разных растворителях положение сигналов отдельных протонов может существенно меняться. В связи с этим были записаны протонные спектры смеси 4-гидроксиметил-1,3-диоксолана 1а и 5-гидрокси-1,3-диоксана 1в в растворителях различной природы (хлороформе, бензоле) рис. 2.2.
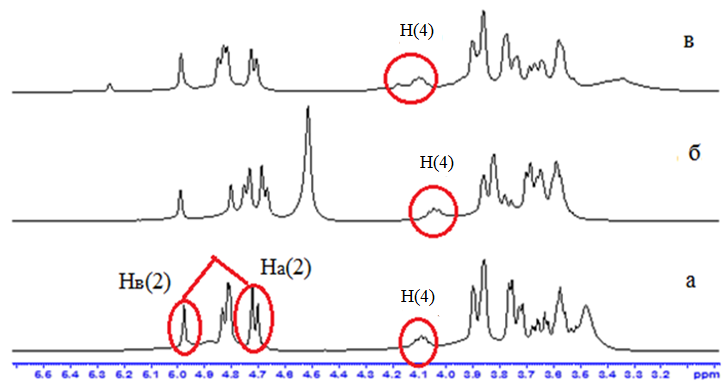
Рисунок 2.2 Фрагмент спектра ЯМР 1Н смеси 4-гидроксиметил-1,3-диоксолана 1а и 5-гидрокси-1,3-диоксана 1б в различных растворителях: а) CDCl3; б) C6D6; в) CDCl3+H2SO4
Как видно из рис. 2.2 наилучшее разрешение пиков наблюдается в бензоле.
Известно, что при наличии pH заместителей во 2 положении смеси диоксан-диоксалановых структур, равновесие смещается в зависимости от температуры в сторону 5-гидрокси-1,3-диоксана.
Нами были проведены эксперименты по снятию спектров ПМР при различных температурах 20ºС, 40ºС, 80ºС для смещения равновесия 4-гидроксиметил-1,3-диоксолана и 5-гидрокси-1,3-диоксана.
Из рис. 2.3 видно что спектр не меняется при вариации температуры. Таким образом, мы не наблюдаем смещения равновесия формалей глицерина сторону какого-либо одного изомеров.

Рисунок 2.3 Фрагмент спектра ЯМР 1Н смеси 4-гидроксиметил-1,3-диоксолана 1а и 5-гидрокси-1,3-диоксана 1б при разных температурах: а) 20ºС, б) 40º С, в) 80º С
2.2 Синтез и структура 4-[(бензилокси)метил]-1,3-диоксолана и 5-(бензилокси)-1,3-диоксана
О -алкилирование бензилхлоридом циклических формалей глицерина 1а,б (схема 2.2) с выходом 75-80% привело к соответствующим простым эфирам 2 а,б. В полученной смеси содержание 5-тизвенной структуры 2а возросло (2а:2б = 2:1). Это связано, очевидно, с большей активностью первичной гидроксильной группы формаля 1а по сравнению с вторичной гидроксильной группой соединения 1б.

Реагенты и условия: С6Н5СН2Cl, 50%-ный р-р NaOH, Q+Cl –, толуол, 70 °C, 1 ч;
Схема 2.2
Отнесение сигналов замещенных гетероциклов 2а, б проведено на основании анализа величин химических сдвигов и КССВ протонов гетероциклического фрагмента (рис.2.2).

а)

б)
a - 4-[(бензилокси)метил]-1,3-диоксолан; б - 5-(бензилокси)-1,3-диоксан.
Рисунок 2.2 - Отнесение сигналов замещенных гетероциклов 4-[(бензилокси)метил]-1,3-диоксолана 2а и 5-(бензилокси)-1,3-диоксана 2б
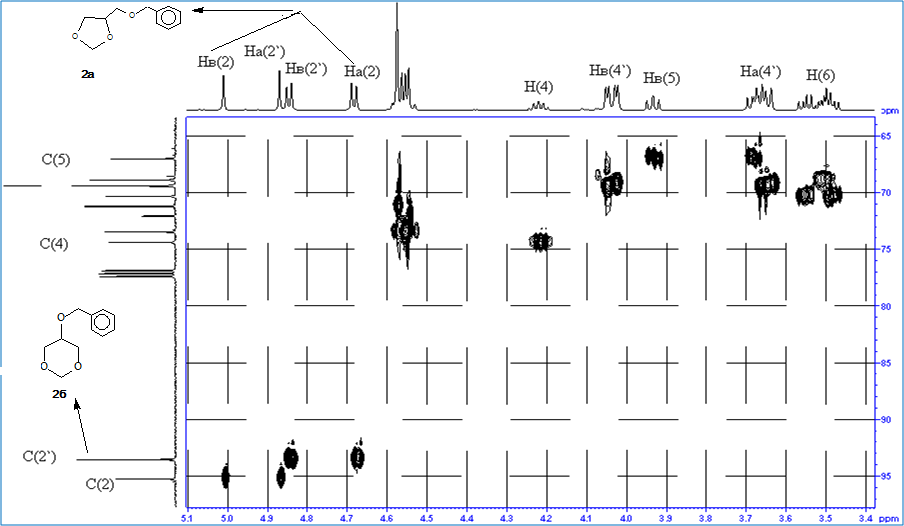
Рисунок 2.3- Фрагмент спектра HSQC 4-[(бензилокси)метил]-1,3-диоксолана и 5-(бензилокси)-1,3-диоксана
Таблица 2.3 – Данные спектров ЯМР 1Н (δ, м. д., J, Гц) соединений 4-[(бензилокси)метил]-1,3-диоксолана 2а и 5-(бензилокси)-1,3-диоксана 2б
| Соединение | Н(2) | Н(4) | Н(5) | Н(6) | Н(8) |
| 2а | 4.39 (с) 5.03 (с) | 4.25 (п, J2 5.9) | 3.71 (т, J3 5.9) 3.73 (т, J3 5.9) | 3.53 (м, J2 10.0, J3 5.9) 3.62 (д.д, J3 5.9, J2 10.0) | 4.57 (д, J2 12.0) 4.59 (д, J2 12.0) |
| 2б | 4.71 (д, J 2 6.05) 4.87 (д, J2 6.05) | 3.68 (д.д, J2 11.4, J3 3.7) 4.06 (д.д, J2 11.4, J3 6.9) | 3.53 (т.т, J3 6.9, J3 3.7) | 3.68 (д.д, J2 11.4, J3 3.7) 4.06 (д.д, J2 11.4, J3 6.9) | 4.57(с) 4.59(с) |
Таблица 2.4 – Данные спектров ЯМР 13С (δ, м. д., J, Гц) соединений 4-[(бензилокси)метил]-1,3-диоксолана 2а и 5-(бензилокси)-1,3-диоксана 2б
| Соединение | С(2) | С(4) | С(5) | С(6) | С(8) | С(9) | С (10-14) | С(11-13) |
| 2а | 95. 3 | 74.4 | 67.1 | 62.8 | 73.5 | 138.7 | 127.8 | 128.2 |
| 2б | 93.6 | 69.5 | 68.9 | - | 71.3 | 137.7 | 127.6 | 128.3 |
Так, в спектре ЯМР 1Н смеси 4-[(бензилокси)метил]-1,3-диоксолана 2а и 5-(бензилокси)-1,3-диоксана 2б синглетные сигналы при δH 4.39 и 5.03 м.д. соответствуют протонам метиленой группы при С(2) атоме диоксолана 2а, метиновые протоны при С(4) атоме диоксоланового кольца проявляются в виде пентета с четырьмя КССВ при δH 4.25 м.д. (J3 5.9, 5.9, 5.9, 5.9 Гц). Эквивалентные протоны С(5)Н2-группы резонируют в области δH 3.71 и 3.95 м.д. в виде триплета с КССВ J2 5.9 Гц и J3 5.9 и 5.9 Гц соответственно. Эквивалентные метиленовые протоны С(6)Н2 – группы проявляются в виде мультиплетов в области δH 3,5 с КССВ 10.0, 5,9 Гц и дублет дублетов в области δH 3,57 также с КССВ 10.0, 5,9 Гц. Метиленовые протоны С(6)Н2 – группы проявляются более слабом поле за счет воздействия бензилной группы, в виде дублетов области δH 4.57 и 4.59 с КССВ 12.0, 12.0 Гц. Мултиплет в области δH 7.3- 7.7 соответствует протонам бензилной группы.
Для 1,3-диоксана 2б положение сигнала протона при δH 3.53 м.д. соответствует метиновому протону при С(5`) атоме с КССВ 3.7, 6.9 Гц.. Аномерные протоны при С(2`) углеродном атоме диоксана 2б резонируют в области δН 4.71 и 4.87 м.д. в виде дублетов и имеют КССВ 6.05 и 6.05 Гц соответственно, что характерно для 5-замещенных 1,3-диоксанов. Аксиальные и экваториальные протоны метиленовой групп при С(4`) атоме химически эквивалентны протонам при С(6`) атоме. Сигналы Нах(4`) и Нах(6`) проявляются в более сильном поле δH 3.68 в виде дублет дублета с КССВ 11.4 Гц, протоны Нeq(4`) и Нeq (6`) резонируют в области δH 3.74 и 3.80 м.д. в идее двух дублетов с одинаковой константой 5.4 Гц и 3.7, 6.9 Гц. Метиленовые протоны С (8`)Н2 - группы резонируют в области δH 4.57 и 4.59 м.д. в виде синглета. Метиновые группы бензилового кольца отражаются в виде мультиплетов в области δH 7.1-7.3.
Date: 2016-05-23; view: 842; Нарушение авторских прав