
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретичні відомості. Високомолекулярні сполуки (ВМС) отримали свою назву завдяки великій величині їхньої молекулярної маси
|
|
Високомолекулярні сполуки (ВМС) отримали свою назву завдяки великій величині їхньої молекулярної маси, яка відрізняє їх від низькомолекулярних сполук (НМС). До високомолекулярних сполук прийнято відносити речовини з молекулярною масою не менше 5000. Таку велику молекулярну масу можуть мати тільки хімічні речовини, молекули яких складаються з багатьох сотень атомів. Молекули ВМС внаслідок великих розмірів та мас називають макромолекулами.
Всі макромолекули ВМС незалежно від будови мономерної ланки мають ланцюгову будову. У процесі синтезу лінійне розташування у ланцюгу може порушуватися, можуть утворюватися просторові або зшиті структури макромолекул. Так, природний каучук має лінійне розташування ланок у ланцюгу, крохмаль – розгалужене, а вулканізований каучук (гума) є типовим прикладом зшитої структури.
Розчини ВМС мають властивості як істинних, так і колоїдних розчинів, а також проявляють специфічні властивості, що притаманні тільки ВМС, наприклад, набухання та драглеутворення.
ВМС у споріднених розчинниках утворюють молекулярні (істинні)розчини. Розчини ВМС утворюються довільно зі зменшенням вільної енергії і тому вони термодинамічно стійкі. Стійкість розчину ВМС визначається тим, що зв’язок між макромолекулами слабший, ніж зв’язок між макромолекулами і молекулами розчинника. Тому сухий залишок ВМС при додаванні до нього розчинника переходить у розчин. Розчини ВМС можуть бути як молекулярними, так і іонними. В усіх випадках вони є гомогенними системами. Всі перераховані ознаки характерні для істинних розчинів.
Розчини ВМС мають і деякі властивості ліофобних колоїдних розчинів, оскільки розміри макромолекул ВМС відповідають розмірам частинок високодисперсних систем – 10-7÷10-9м. Макромолекули ВМС не проходять крізь напівпроникні мембрани. Макромолекули розчинів ВМС подібно частинкам колоїдних розчинів здатні до броунівського руху і дифузії, а також до розсіювання світла. Для розчинів ВМС характерні осмос, зворотний осмос і ультрафільтрація. Макромолекули ВМС в рідкому середовищі можуть утворювати суспензії, емульсії, піни. Для них характерні такі поверхневі явища, як адсорбція та адгезія.
ВМС розчиняються лише у тих розчинниках, до яких вони ліофільні: гідрофільні полімери розчиняються у воді та інших полярних розчинниках, а олеофільні – у вуглеводневих. Наприклад, желатин при нагріванні розчиняється у воді і утворює істинний розчин, тому що до його складу входять полярні групи –СООН і –NH2, які мають спорідненість до води. Якщо воду замінити на спирт, тоді істинний розчин желатину переходить у колоїдний і утворюється гель. Каучук розчинний у бензолі, бензині та інших вуглеводнях, але не розчинний у воді і утворює у водному середовищі колоїдні розчини, які називають латексами.
Розчини ВМС мають і специфічні властивості: їм притаманна висока в’язкість і здатність до набухання і драглеутворення.
Процес розчинення високомолекулярних сполук проходить у дві стадії. Перша стадія – це набухання ВМС, а друга – безпосередньо розчинення. Набухання – це мимовільний процес поглинання молекул розчинника (НМС) молекулами ВМС, що супроводжується значним збільшенням об’єму та маси полімеру. Воно характеризується ступенемнабухання α:
 (12.1)
(12.1)
де m0, m – маси наважки ВМС до і після набухання; mp – маса поглиненої рідини.
Ступіньнабухання – це кількість рідини, що поглинається одиницею маси ВМС. Ступінь набухання змінюється в широких межах і для природних ВМС може досягати 1600%.
Причиною набухання є різниця властивостей двох компонентів ВМС і НМС (розчинника), тобто низькомолекулярної сполуки. Специфіка набухання полягає в тому, що взаємодіють і змішуються молекули різного розміру і вони, відповідно, мають різні швидкості дифузії. Тому перехід макромолекул в фазу розчинника відбувається дуже повільно, тоді як молекули НМС дуже рухливі, вони швидко дифундують в сітку полімеру, розсувають ланцюги і збільшують його об’єм.
Здатність до набухання – це специфічна властивість високомолекулярних сполук, яка залежить від їхнього складу та будови і визначається сольватацією макромолекул. Тому набухання завжди супроводжується виділеннямтеплоти (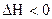 ) і збільшенням об’єму полімеру, а об’єм усієї системи (полімер + розчинник) зменшується. Зменшення об’єму системи (її стиснення) в цілому при набуханні називається контракцією.
) і збільшенням об’єму полімеру, а об’єм усієї системи (полімер + розчинник) зменшується. Зменшення об’єму системи (її стиснення) в цілому при набуханні називається контракцією.
Процес набухання може бути обмеженим або необмеженим. Набухання називається обмеженим, якщо в надлишку розчинника ВМС набухає до певної межі і цей процес закінчується утворенням драглів, а не розчиненням ВМС. Прикладом обмеженого набухання є набухання желатину у холодній воді. Обмежено набухлий полімер називається драглі.
Набухання вважається необмеженим, якщо в надлишку розчинника драглі полімеру мимовільно переходять в розчин із зростанням ентропії системи. Прикладом необмеженого набухання є желатин у гарячій воді.
Для одного й того ж ВМС і розчинника можна одночасно спостерігати обмежене і необмежене набухання. Наприклад, 10÷20 % крохмалю у гарячій воді розчиняється, а решта – обмежено набухає. Цей процес залежить від будови макромолекул крохмалю, кількості його складових частин (амілозитаамілопектину
Процес набухання описується кінетичним рівнянням першого порядку:
 (12.2)
(12.2)
де  – швидкість набухання на момент часу t; α – ступінь набухання в момент часу t, α∞ – граничний (максимальний) ступінь набухання; К – константа швидкості набухання.
– швидкість набухання на момент часу t; α – ступінь набухання в момент часу t, α∞ – граничний (максимальний) ступінь набухання; К – константа швидкості набухання.
Величини граничного ступеня набухання α∞ та константи швидкості набухання К можна визначити графічно. Для цього експериментально визначають залежність ступеня набухання від часу, розраховують швидкість набухання в певні моменти часу та будують пряму в координатах  (рис. 9.1). Відрізок, що відсікає пряма на осі ординат, дорівнює α∞, а на осі абсцис – К α∞.
(рис. 9.1). Відрізок, що відсікає пряма на осі ординат, дорівнює α∞, а на осі абсцис – К α∞.
 Рис. 9.1. Залежність ступеня набухання від швидкості набухання полімеру
Рис. 9.1. Залежність ступеня набухання від швидкості набухання полімеру
| Набухання протікає в чотири стадії. На першій стадії відбувається сольватація (гідратація) ВМС. При цьому виділяється теплота  . На другій стадії молекули розчинника дифундують у макромолекули ВМС, полярні молекули розчинника утворюють сольватний (гідратний) шар, відбувається відштовхування однойменних зарядів сольватних оболонок і слабкі зв’язки між макромолекулами рвуться. . На другій стадії молекули розчинника дифундують у макромолекули ВМС, полярні молекули розчинника утворюють сольватний (гідратний) шар, відбувається відштовхування однойменних зарядів сольватних оболонок і слабкі зв’язки між макромолекулами рвуться.
|
На третій стадії спостерігається взаємне проникнення молекул ВМС і НМС. Об’єм набухлого полімеру стає ще більший. На цій стадії теплота сольватації майже не виділяється ( ), але зростає ентропія, що пов’язано з частковим вивільненням макромолекул і збільшенням числа їх конформацій
), але зростає ентропія, що пов’язано з частковим вивільненням макромолекул і збільшенням числа їх конформацій  ,
,  . Таким чином, третя стадія набухання обумовлена ентропійним ефектом. На четвертій стадії утворюється гомогенна система – розчин. Якщо процес набухання протікає в чотири стадії, то має місце необмежене набухання. Якщо ж процес обмежується другою або третьою стадією набухання – це обмежене набухання, утворюються драглі.
. Таким чином, третя стадія набухання обумовлена ентропійним ефектом. На четвертій стадії утворюється гомогенна система – розчин. Якщо процес набухання протікає в чотири стадії, то має місце необмежене набухання. Якщо ж процес обмежується другою або третьою стадією набухання – це обмежене набухання, утворюються драглі.
На ступінь набухання та розчинення ВМС впливають різні фактори. В першу чергу, це природа полімеру і розчинника. Полярні полімери добре розчиняються у полярних розчинниках, а неполярні – в неполярних органічних рідинах.
З підвищенням в’язкості розчинника швидкість його дифузії в макромолекули ВМС зменшується, що викликає сповільнення процесу набухання.
Температура і тиск впливають на набухання (розчинення) за принципом Ле Шательє. Оскільки набухання відбувається з виділенням теплоти, то з підвищенням температури ступінь набухання зменшується, але швидкість набухання зростає завдяки збільшенню швидкості дифузії.
При збільшенні молекулярної маси полімеру процеси набухання протікають повільніше, а розчинність зменшується.
Набухання поліелектролітів у воді залежить від рН середовища. Розглянемо це явище на прикладі білків, молекули яких містять полярні групи –NH2 та –СООН.
У кислому середовищі при надлишку іонів Н+ желатин, завдяки іонізації аміногруп, заряджається позитивно, диполі води електростатично притягуються і орієнтуються – відбувається гідратація макромолекул. Під впливом однойменних позитивних зарядів і електростатичного відштовхування відбувається розтягування ланцюгів білка. У таких випадках гідратація супроводжується набуханням желатину.

 NH3+ NH3+
NH3+ NH3+

 R + H+ → R
R + H+ → R
COO- COOH
В лужному середовищі виникає дисоціація кислотних груп, желатин заряджається негативно і набухає.

 NH3+ NH3OH
NH3+ NH3OH
 R + OH- → R
R + OH- → R
 COO- COO-
COO- COO-
Таким чином заряд білка буде залежать від рН середовища і від співвідношення карбоксильних і амінних груп у макромолекулі. Ізоелектричнаточка (ІЕТ) – це таке значення рН, при якому кількість іонізованих основних і кислотних груп в молекулі білку однакова і макромолекули згортаються в щільний клубок або спіраль. При цьому ступінь набухання білка мінімальний. При збільшенні або зменшенні рН від ізоелектричної точки однойменно заряджені групи відштовхуються, макромолекули розгортаються і набухання збільшується.
Значення рН ізоелектричної точки для деяких білків складає: казеїн – 4,6; желатин – 4,7; яєчний альбумін – 4,8; глобулін – 5,4; гліадін пшениці – 9,8.
При введенні електролітів в розчини ВМС спостерігається процес висолювання. При висолюванні відбувається боротьба за воду між макромолекулами та іонами. Іони електроліту зменшують кількість вільної води, що припадає на макромолекули ВМС. Це викликає виділення ВМС з розчину, тобто драглеутворення.
Висолювання із водних розчинів ВМС може відбуватися і при додаванні спирту, ацетону та інших органічних розчинників. Ці речовини з водою гідролізуються. Вони руйнують гідратну оболонку, знижують розчинність ВМС і утворюють осад. Це явище використовують для виділення із водних розчинів білків, а часто і для розділення їх на фракції. Для цього спирт добавляють порціями, спочатку випадають білки з великою молекулярною масою, тому що їх розчинність менша. При додаванні наступних порцій спирту в осад випадають білки з меншою молекулярною масою.
Швидкість і ступінь набухання полярних ВМС у воді зменшуються з додаванням спирту та інших нерозчинників, молекули яких добре гідратуються водою і тому є дегідратуючими агентами для полімеру.
Date: 2016-01-20; view: 646; Нарушение авторских прав