
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретичні відомості. Під стійкістю дисперсних систем розуміють сталість у часі її стану та основних властивостей: дисперсності
|
|
Під стійкістю дисперсних систем розуміють сталість у часі її стану та основних властивостей: дисперсності, рівномірного розподілення частинок дисперсної фази у об’ємі дисперсійного середовища, збереження характеру взаємодії між частинками тощо. Особливо важливою є стійкість ліофобних колоїдів, оскільки вони термодинамічно нестабільні і здатні до коагуляції.
Седиментаційна стійкість – це здатність системи зберігати рівномірне розподілення частинок в об’ємі дисперсійного середовища. Основними умовами цієї стійкості є висока дисперсність та участь частинок дисперсної фази в броунівському русі.
Агрегативна стійкість – це здатність системи зберігати свою ступінь дисперсності, тобто не змінювати розміри частинок під впливом зовнішніх факторів. За цими ознаками системи поділяються на два класи:
1) термодинамічно стійкі (ліофільні) системи, які самочинно диспергуються та існують без додаткової стабілізації. Сюди відносяться міцелярні розчини ПАР та розчини ВМС. При утворенні таких систем вільна енергія Гіббса зменшується, тобто ∆G < 0;
2) термодинамічно нестійкі (ліофобні) системи. Сюди відносяться золі, суспензії та емульсії, тобто системи, у яких слабка взаємодія між частинками дисперсної фази та дисперсійним середовищем. При утворенні таких систем виникає велика поверхня розділу фаз. Вони мають значний надлишок вільної поверхневої енергії, тобто ∆G > 0. Такі системи термодинамічно нестійкі. В них відбуваються самочинно процеси, що призводять до зменшення поверхневої енергії за рахунок збільшення розмірів колоїдних частинок внаслідок їх злипання та подальшої коагуляції.
Коагуляцією називається процес злипання частинок дисперсної фази під дією міжмолекулярних сил притягування. Коагуляцію золю може викликати будь-який фактор, що порушує агрегативну стійкість системи, але найважливішим фактором є дія електролітів. Відповідно з теорією ДЛФО введений електроліт у дисперсну систему спричиняє стиснення ПЕШ, а отже і зменшення ζ–потенціалу, який відповідає за її стійкість. Коагуляція золів може відбутися і внаслідок дії фізичних факторів.
Відповідно до теорії ДЛФО, введення електроліту в дисперсну систему спричиняє стиснення ПЕШ на поверхні частинок, внаслідок чого вони можуть зблизитися до відстані, на якій переважають сили притягування. Зменшення товщини ПЕШ супроводжується обміном протиіонів дифузного шару на іони електроліту, які спричиняють коагуляцію. Стиснення ПЕШ відбувається як за рахунок зменшення електричного потенціалу внаслідок специфічної адсорбції іонів введеного електроліту, так і через обмеження дифузії протиіонів у розчин у зв’язку зі збільшенням іонної сили розчину.
Згідно з правилом Шульце – Гарді коагулююча дія властива тому іону електроліту, що має заряд, протилежний заряду колоїдної частинки; коагулююча дія тим сильніша, чим вищий заряд іона-коагулятора. Оскільки колоїдна частинка золю гідроксиду заліза заряджена позитивно, то коагулюючу дію матимуть аніони електролітів, введених у даний золь.
Критичне мінімальне значення концентрації введеного у золь електроліту, за якої даний електроліт спричиняє коагуляцію даного золю, називають порогом коагуляції. Поріг коагуляції розраховують за рівнянням
 , (11.1)
, (11.1)
де С – концентрація електроліту, моль/л; n – кількість мілілітрів дистильованої води, взятих для розведення.
Коагулююча дія – це величина, обернено пропорційна порогу коагуляції:
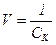 . (11.2)
. (11.2)
Коагулююча дія виражається числом об’ємів золю, скоагульованих одним молем іона-коагулятора.
Date: 2016-01-20; view: 550; Нарушение авторских прав