
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретичні відомості. Адсорбція– це процес накопичення молекул розчиненої речовини або газу на поверхні поділу фаз
|
|
Адсорбція – це процес накопичення молекул розчиненої речовини або газу на поверхні поділу фаз. Він супроводжується енергетичною зміною системи – виділенням або поглинанням теплоти. Цей процес відбувається самовільно, оскільки в результаті його проходження знижується поверхневий натяг на межі поділу фаз і зменшується вільна поверхнева енергія. Речовина, на поверхні якої відбувається адсорбція, називається адсорбентом, а речовина, що накопичується – адсорбтивом (адсорбатом).
Залежно від агрегатного стану адсорбенту та адсорбтиву розрізняють три типи адсорбції: адсорбцію газу на поверхні твердого тіла, розчиненої речовини на межі поділу рідина – газ та адсорбцію розчиненої речовини на межі тверде тіло – розчин.
Графічна залежність кількості адсорбованої речовини від рівноважного тиску Г=f(P) або від концентрації Г=f(С) при сталій температуріназивається ізотермою адсорбції.
Накопичення молекул на твердому адсорбенті може бути чисто фізичним процесом (фізична адсорбція) або супроводжуватись хімічною реакцією на поверхні адсорбенту – хімічна адсорбція (хемосорбція).
Хемосорбція – хімічний процес, який потребує значної енергії активації, через це збільшення температури сприяє хемосорбції.
І. Ленгмюр створив і обґрунтував теорію мономолекулярної адсорбції газів на твердому адсорбенті, припустивши, що активні центри рівномірно розподілені на поверхні і адсорбція локалізована.
Рівняння ізотерми адсорбції Ленгмюрамає вигляд
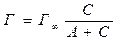 (8.1)
(8.1)
де Г – адсорбція, моль/м2; Г∞ – гранична адсорбція (ємність моношару); А – стала, що характеризує поверхневу активність адсорбтиву; С – рівноважна концентрація, моль/л.
Для визначення сталих А і Г∞ рівняння Ленгмюра для адсорбції можна привести до рівняння прямої і записати у вигляді:
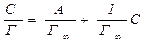 (8.2)
(8.2)
Пряма, побудована в координатах С /Г=f(С) не проходить через початок координат (рис. 7.3) і відтинає на вісі відрізок, що дорівнює 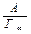 . Гранична адсорбція Г∞ визначається за котангенсом кута нахилу прямої до вісі абсцис: Г∞=ctga.
. Гранична адсорбція Г∞ визначається за котангенсом кута нахилу прямої до вісі абсцис: Г∞=ctga.
При адсорбції з розчинів на твердих адсорбентах прийнято розрізняти молекулярну адсорбцію, тобто адсорбцію неелектролітів, коли речовина адсорбується у молекулярному стані, та іонну адсорбцію, коли вибірково адсорбується один з іонів електроліту.
При молекулярній адсорбції молекули розчиненої речовини і розчинника здатні до адсорбції на твердій поверхні і можуть адсорбуватись одночасно. Переважна адсорбція тих чи інших молекул буде визначатися їх здатністю зменшувати вільну поверхневу енергію на межі поділу адсорбент – розчин. Речовина, яка більшою мірою знижує значення поверхневої енергії s адсорбенту, буде адсорбуватися переважно в більших кількостях.
Згідно теорії Ленгмюра адсорбція на твердих адсорбентах проходить не на всій поверхні, а тільки на адсорбційно-активних центрах з надлишком вільної поверхневої енергії. Тому, необхідно підбирати адсорбент, який не взаємодіє з розчинником.
Молекулярна адсорбція залежить від природи адсорбенту в тому середовищі, в якому розчинені молекули адсорбтиву. Полярні адсорбенти – глина, силікагель, алюмогель, цеоліти – добре змочуються водою. Такі адсорбенти краще адсорбують поверхнево-активні речовини з вуглеводневих (неполярних) середовищ, оскільки взаємодія між полярним адсорбентом і вуглеводневим середовищем незначна. Неполярні адсорбенти – вугілля, тальк – краще адсорбують речовини з водних розчинів.
Такий вплив на адсорбцію природи адсорбенту, адсорбтиву і середовища підпорядковується правилу вирівнювання полярностей Ребіндера – процес адсорбції йде в бік вирівнювання полярностей фаз ітим сильніше,чимбільша початкова різниця полярностей. Іншими словами – речовина буде адсорбуватись на поверхні адсорбенту, якщо своєю присутністю в поверхневому шарі вона зменшує різницю полярностей фаз. Через це для адсорбції, наприклад, оцтової кислоти з води слід використовувати неполярний адсорбент – вугілля, тальк; а для адсорбції її з неполярного середовища – бензолу, толуолу – полярний адсорбент – силікагель, алюмогель.
Адсорбцію на порошкоподібному адсорбенті можна розрахувати таким чином. Якщо в розчин об’ємом V з початковою концентрацією ПАР С0 всипати пористий порошкоподібний адсорбент (активоване вугілля) масою m, то частина ПАР із розчину буде адсорбуватися на твердій поверхні. В результаті концентрація речовини в розчині знизиться до Ср, величина надлишкової (гіббсівської) адсорбції буде:
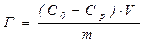 (8.3)
(8.3)
Дане рівняння показує кількість ПАР, що адсорбувалися на поверхні твердого тіла. Адсорбція буде виражатися в моль/кг.
Орієнтація молекул ПАР на межі розділу тверде тіло – рідина буде відбуватися згідно правила вирівнювання полярностей Ребіндера. На межі вугілля (неполярна фаза) з водою (полярна фаза) адсорбційний шар молекул ПАР орієнтується гідрофільною частиною до рідини. Адсорбційний шар молекул ПАР вкриває тверду поверхню і надає їй полярні властивості (Рис.8.1,а). Таким чином, межа поділу неполярне тверде тіло – полярна рідина в результаті адсорбції замінюється на межу поділу полярна частина адсорбційного шару на твердій поверхні – полярна рідина. Відбулося вирівнювання полярностей фаз: неполярно – полярна межа стала полярно – полярною.
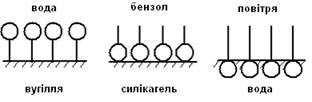
Рис. 8.1. Схема орієнтації молекул ПАР на межі фаз різної природи
Розглянемо другий приклад, коли гідрофільна поверхня твердого тіла (силікагель) контактує з неполярною рідиною (бензол) (рис. 8.1,б). При цьому молекули ПАР орієнтуються навпаки – гідрофобна, неполярна, вуглеводнева частина повернена в сторону неполярного бензолу, а гідрофільна – в сторону полярного силікагелю. І вихідна границя поділу полярне тверде тіло – неполярна рідина в результаті адсорбції замінюється на неполярний адсорбційний шар твердої поверхні – неполярна рідина.
Отже всі полярні гідрофільні поверхні повинні добре адсорбувати ПАР з неполярних або слабополярних рідин і, навпаки, неполярні гідрофобні поверхні добре адсорбують ПАР з полярних рідин. З ростом молекулярної маси ПАР здатність до адсорбції зростає, тобто тут також діє правило Траубе. У гомологічному ряду органічних речовин /кислот, спиртів/ адсорбційна здатність збільшується у міру зростання довжини вуглеводневого ланцюга. Значення адсорбції при переході від одного гомолога до наступного збільшується в 1,5 рази. На молекулярну адсорбцію впливає пористість адсорбенту та розмір його пор.
Date: 2016-01-20; view: 734; Нарушение авторских прав