
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Осмос и осмотическое давление
|
|
К коллигативным свойствам растворов относятся осмос и вызываемое им осмотическое давление.

В сосуд, разделенный полунепроницаемой перегородкой АВ (мембраной) с одной стороны помещен раствор сахара в воде, с другой стороны чистая вода (растворитель).
Полунепроницаемая перегородка АВ пропускает в обе стороны молекулы воды, но не пропускает молекулы растворенного вещества (сахар). Примером полунепроницаемой перегородки может быть бычий пузырь.
Концентрация растворителя (вода) по обе стороны полунепроницаемой перегородки будет неодинакова. В правой части сосуда некоторый объем занимают молекулы растворенного вещества и концентрация растворителя будет меньше, чем в левой части сосуда с чистым растворителем. Растворитель из области более высокой концентрации самопроизвольно будет перемещаться в область с меньшей концентрацией, т.е. из левой части сосуда в правую. Это перемещение называют осмосом, которое на рис. покажем стрелками.
Осмос – это самопроизвольный процесс перехода растворителя через полунепроницаемую перегородку (мембрану) из растворителя в раствор или из менее концентрированного раствора в более концентрированный.
При переходе воды из левой части сосуда в правую, в этой части сосуда будет увеличиваться уровень жидкости на величину h. Одновременно на эту же величину h уровень жидкости в левой части сосуда понизится. Разность между уровнями жидкости в левом и правом коленах, при которой прекращается переход растворителя, определяет величину осмотического давления.
Осмотическое давление можно выразить следующим образом:
 – уравнение Вант-Гоффа, где
– уравнение Вант-Гоффа, где
 осмотическое давление; n – число молей растворенного вещества.
осмотическое давление; n – число молей растворенного вещества.
Это уравнение по имени автора называется уравнением Вант-Гоффа.
Для молярной концентрации (С=n/V):

Уравнение Вант-Гоффа показывает, что осмос и вызванное им осмотическое давление зависят только от количества растворенного вещества, а не от его природы (коллигативные свойства).
Уравнение Вант-Гоффа напоминает уравнение состояния идеального газа pV=nRT. Подобное совпадение не случайно – оба уравнения отражают фундаментальное сходство систем на молекулярном уровне. В условиях равновесия осмотической системы растворенное вещество аналогично атомам идеального газа. Растворитель является лишь носителем растворенного вещества подобно роли вакуума для идеального газа.
Уравнение Вант-Гоффа позволяет рассчитать осмотическое давление, которое численно равно избыточному внешнему давлению, которое следует приложить к раствору, чтобы предотвратить осмос и восстановить одинаковый уровень жидкости раствора и растворителя, разделенных между собой полунепроницаемой перегородкой.
Пример. Рассчитать осмотическое давление  водного раствора, содержащего g=68,4 г сахарозы (
водного раствора, содержащего g=68,4 г сахарозы (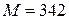 г/моль) и 1000 г воды, плотность раствора при t=20
г/моль) и 1000 г воды, плотность раствора при t=20  C
C  кг/м
кг/м  .
.
 =
= 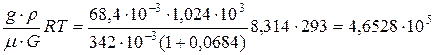 Па=4 атм.
Па=4 атм.
Осмос и осмотическое давление играют существенную роль в жизни растений и живых организмов. Так, оболочка клеток выполняет роль полупроницаемой мембраны.
Изотонический коэффициент i (коэффициент Вант-Гоффа).
Мы показали, что повышение температуры кипения определяется уравнением:

Отсюда молекулярная масса растворенного вещества:

Для многих случаев экспериментальная молярная масса практически равна истинной молярной массе.
Но в ряде случаев экспериментальная молярная масса очень сильно отличается от истинной. Дело в том, что эти эффекты пропорциональны числу растворенных частиц.
 =
= 
Например, при растворении сахара в растворе есть одна частица сахара С  ,
,
сахар 1 частица С 
а при растворении KCl образуются две частицы KCl
2 частицы KCl 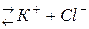
Т.к.  , где m-моляльная концентрация растворенного вещества. В этом случае нужно учесть образование двух частиц при растворении KCl.
, где m-моляльная концентрация растворенного вещества. В этом случае нужно учесть образование двух частиц при растворении KCl.
В случае электролитов вводится понятие изотонического коэффициента (коэффицента Вант – Гоффа i), который показывает, во сколько раз увеличивается число частиц в растворе в результате диссоциации.
В общем случае изотонический коэффициент равен:
 i =2
i =2
Na 
 i =3
i =3
Однако при растворении не все молекулы электролита распадаются на ионы, оценивается степенью электролитической диссоциации, или просто степенью диссоциации, которую обычно обозначают  .
.
Пусть растворили N молекул вещества степень диссоциации равна:
 =
= 
Тогда число продиссоциировавших молекул:
N 
Неподвергшихся диссоциации молекул в растворе:
N 
Пусть при диссоциации одной молекулы образуется 2 иона (обозначим число ионов, на которые распадается молекула через  ).Тогда число ионов равно:
).Тогда число ионов равно:
N 
Число растворенных частиц = N 
Тогда изотонический коэффициент равен
i = 
i = 1-  +
+ 

i = 1+  (
(
Пример. Пусть хлорид натрия неполностью диссоциирует на ионы:
 ;
;  ;
; 
Тогда изотонический коэффициент равен:
i=1+  (
( =1+0,95(2-1)=1,95
=1+0,95(2-1)=1,95
Изотонический коэффициент характеризует такие коллигативные свойства растворов электролитов, как повышение температуры кипения, понижение температуры замерзания, осмотическое давление и давление пара растворителя над раствором.
Для растворов электролитов повышение температуры кипения и понижение температуры замерзания будут описываться следующими выражениями:
 ;
;  ,
,
где m – моляльность раствора.
На основании вышеприведенных формул можно вывести формулу для определения истинной молярной массы вещества:
 или
или

Однако, при отделении молярной массы растворенного вещества большое значение имеет выбор растворителя.
Например, криоскопическим методом определили молярную массу уксусной кислоты. В водном растворе молярная масса  г/моль, что полностью соответствует формуле. В растворе бензола молярная масса уксусной кислоты равна
г/моль, что полностью соответствует формуле. В растворе бензола молярная масса уксусной кислоты равна  г/моль. Это указывает на существование в растворе молекул (СН
г/моль. Это указывает на существование в растворе молекул (СН  СООН)
СООН)  .Действительно, в бензоле между молекулами уксусной кислоты образуется водородная свзяь:
.Действительно, в бензоле между молекулами уксусной кислоты образуется водородная свзяь:
CH  -C
-C 
В воде это невозможно, т.к. вода сама образует водородные связи:
CH  -C
-C 
Date: 2016-02-19; view: 659; Нарушение авторских прав