
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Криоскопия
|
|
Из опыта известно, что температура замерзания растворов ниже, чем чистого растворителя. Вспомним хотя бы зимние улицы, когда после посыпания их солью образуется раствор, который не замерзает при минусовой температуре.
Понижение температуры замерзания также можно определить графически.

Понижение температуры замерзания раствора объясняется тем, что растворенное вещество препятствует кристаллизации растворителя, т.е. его переходу из жидкого в твердое состояние.
Понижение температуры замерзания определяется как разность между температурой замерзания растворителя и температурой замерзания раствора:
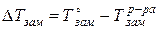
По аналогии с определением повышения температуры кипения находят понижение температуры замерзания раствора:
 =
=  , где
, где
 – мольная энтальпия замерзания (плавления) растворителя;
– мольная энтальпия замерзания (плавления) растворителя;
Т  – температура замерзания растворителя;
– температура замерзания растворителя;
 – молярная масса растворителя;
– молярная масса растворителя;
К – криоскопическая постоянная 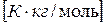 .
.
К  =1,86 К∙кг/моль
=1,86 К∙кг/моль
С помощью измерений понижения температуры замерзания можно определить молярную массу растворенного вещества по формуле:
 – для растворов неэлектролитов
– для растворов неэлектролитов
g – масса растворенного вещества (в граммах);
G – масса растворителя (в граммах).
Этот метод определения молекулярной массы растворенного вещества называется криоскопией.
В связи с тем, что экспериментально легче определить понижение температуры замерзания раствора, предпочтение отдается определению молекулярной массы растворенного вещества методом криоскопии.
Пример. Определим молекулярную массу С  Н
Н  ОН водного раствора этилового спирта, содержащего 8,74 г спирта на 1000 г воды, если раствор замерзает при температуре -0,354
ОН водного раствора этилового спирта, содержащего 8,74 г спирта на 1000 г воды, если раствор замерзает при температуре -0,354  С, а криоскопическая постоянная для воды равна 1,86
С, а криоскопическая постоянная для воды равна 1,86 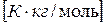 .
.
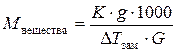 =
=  г/моль
г/моль
Определим температуру замерзания водного раствора, содержащего 30 г глюкозы ( г/моль) и 50 г воды.
г/моль) и 50 г воды.
В соответствии с формулой  , определим моляльную концентрацию глюкозы:
, определим моляльную концентрацию глюкозы:
m=  =
=  =3,33 моль/кг
=3,33 моль/кг
 =1,86∙3,33=6,3
=1,86∙3,33=6,3  С
С
Температура замерзания раствора:
T 
 C
C
Повышение температуры кипения и понижение температуры замерзания являются коллигативными свойствами растворов.
Date: 2016-02-19; view: 625; Нарушение авторских прав