
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Эбуллиоскопия
|
|
Двухкомпонентные растворы, один из компонентов которого нелетуч.
Рассмотрим бесконечно разбавленные растворы нелетучих веществ.
ЭБУЛЛИОСКОПИЯ.
Рассмотрим раствор сахара в воде, который подчиняется закону Рауля.
Сахар является нелетучим компонентом, поэтому над раствором есть только насыщенный пар воды p  . Давление этого насыщенного пара меньше, чем давление насыщенного пара воды над чистой водой и определяется по закону Рауля:
. Давление этого насыщенного пара меньше, чем давление насыщенного пара воды над чистой водой и определяется по закону Рауля:
p  = p
= p 
 ; p
; p  < p
< p 
Зависимость давления насыщенного пара над разбавленным раствором или над чистым растворителем от температуры можно отобразить графически:

Известно, что любая жидкость закипает тогда (при такой температуре), когда давление насыщенного пара становится равным внешнему давлению.
Таким образом, температура кипения – это та температура, при которой давление насыщенного пара жидкости становится равным внешнему давлению.
Рассмотрим чистую воду, которая при нормальном давлении в 1 атмосферу будет кипеть при t=100  C (373 К).
C (373 К).
Очевидно, что раствор сахара в воде будет кипеть при более высокой температуре при том же давлении (1 атм.). Это мы можем показать графически, продолжив прямую, параллельную оси абсцисс до пересечения кривой зависимости давления насыщенного пара над раствором. Опустив перпендикуляр из этой точки на ось абсцисс, получим температуру кипения раствора сахара при давлении 1 атм (Т  ).
).
Все растворы нелетучих веществ кипят при более высокой температуре, чем чистый растворитель.
Повышение температуры кипения раствора  определяется как разность между температурой кипения раствора Т
определяется как разность между температурой кипения раствора Т  и температурой кипения чистого растворителя
и температурой кипения чистого растворителя  :
:


(для раствора сахара в воде  = Т
= Т  -100).
-100).
Повышение температуры кипения в зависимости от свойств раствора можно количественно определить двумя способами:на основе термодинамических представлений и из фазовых диаграмм состояния. Рассмотрим эти два способа.
Первый способ образуется на использовании уравнений химического потенциала  и уравнения Клапейрона–Клаузиуса
и уравнения Клапейрона–Клаузиуса
 .
.
После соответсвуюәих преоразований из этих уравнений получим:
 =
=  где
где
 – мольная энтальпия испарения растворителя;
– мольная энтальпия испарения растворителя;
 – молярная масса растворителя;
– молярная масса растворителя;
m – моляльность раствора, т.е. моляльная концентрация растворенного вещества (количество молей растворенного вещества в 1000 г растворителя);
Е – эбуллиоскопическая постоянная 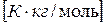 .
.
То же выражение можно получить, рассматривая диаграммы состояния.

Для бесконечно разбавленного раствора и бесконечно малых участков кривых можно считать, что эти участки прямолинейны. Отсюда следует, что повышение температуры кипения пропорционально давлению насыщенного пара, которое в свою очередь определяется концентрацией растворенного вещества. Иными словами, повышение температуры кипения пропорционально концентрации растворенного вещества, что и выражает уравнение.

Эбуллиоскопическая постоянная Е зависит только от природы растворителя и не зависит от растворенного вещества.
Когда моляльная концентрация вещества равна единице (m=  ), то получим
), то получим  , то есть эбуллиоскопическая постоянная одномоляльного раствора равна повышению температуры кипения (
, то есть эбуллиоскопическая постоянная одномоляльного раствора равна повышению температуры кипения ( ), если этот раствор рассматривать как бесконечно разбавленный.
), если этот раствор рассматривать как бесконечно разбавленный.
Пример. Определить температуру кипения водного раствора, содержащего 3 г глюкозы (С  Н
Н  О
О  ) в 100 см
) в 100 см  воды. Молярная масса глюкозы
воды. Молярная масса глюкозы  г/м, эбулиоскопическая постоянная воды Е
г/м, эбулиоскопическая постоянная воды Е  =0,52 (К
=0,52 (К 
Решение: т.к. плотность воды Р  =1 г/см
=1 г/см  , то масса воды 100 г.
, то масса воды 100 г.
В 100 г воды растворено 3 г глюкозы.
В 1000 г воды растворено 30 г глюкозы.
Число молей глюкозы равно:
n=  (моль).
(моль).
Тогда моляльность глюкозы: m=  =0,167 моль/кг.
=0,167 моль/кг.
Повышение температуры кипения равно:
 =0,52
=0,52  =0,087 K (
=0,087 K ( C)
C)
Тогда температура кипения раствора глюкозы равна:
T  =T
=T  +
+ 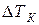 =100+0,087=100,087
=100+0,087=100,087  C
C
Определение молекулярной массы растворенного вещества.
Пусть в G г растворителя растворено g г нелетучего вещества с молекулярной массой  .
.
 – число молей вещества.
– число молей вещества.
 – число молей в G г растворителя.
– число молей в G г растворителя.
Тогда моляльность этого вещества в растворе:
M= 
Подставим это уравнение в уравнение 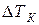 :
:  . Из этого уравнения можно выразить молекулярную массу растворенного вещества:
. Из этого уравнения можно выразить молекулярную массу растворенного вещества:  . Обычно эбуллиоскопическую постоянную Е определяют из справочника, а
. Обычно эбуллиоскопическую постоянную Е определяют из справочника, а 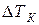 -экспериментально.
-экспериментально.
Определение молекулярной массы растворенного вещества по повышению температуры кипения называется эбуллиоскопией и относится к физико–химическим методам анализа.
Date: 2016-02-19; view: 525; Нарушение авторских прав