
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Обобщенная формула для изменения энтропии
|
|
Понятие «энтропии» предложено в середине 19-го столетия немецким физиком, «отцом термодинамического анализа» Рудольфом Клаузиусом, кото-рому историей науки отдается приоритет открытия второго закона термодина-мики. Однако автор не дал физического смысла энтропии. В течение полутора веков многими учеными предлагались различные толкования физического смысла энтропии. Каждое из них имело свои достоинства и недостатки. Однако достоверного общепризнанного толкования физического смысла энтропии нет и сегодня.
Опуская дискуссионные аспекты, связанные с понятием «энтропии», рассмотрим практические приложения энтропии в термодинамическом анализе.
Обобщенная формула для изменения энтропии:
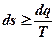 ,
,
где s – энтропия.
Знак равенства относится к обратимым процессам, а неравенства - к необратимым.
Энтропия – калорический параметр состояния и обладает всеми свойствами параметров.
1кг ‚ 
m кг ‚  .
.
"Тепловая смерть Вселенной" (Клаузиус): состояние всеобщего теплового равновесия, когда температура всех тел во Вселенной одинакова. Работа не совершается, тепло не передается от одного тела к другому, в том числе и живым организмам.
Таким образом, для обратимых процессов, которые мы и рассматриваем, формула для изменения энтропии имеет вид:
 .
.
Изменение энтропии в процессе является признаком теплового взаимодействия рабочего тепла с окружающей средой. Так как абсолютная температура Т всегда положительна, то знак теплоты определяется знаком энтропии. Процесс увеличения энтропии  означает подвод теплоты, а процесс уменьшения
означает подвод теплоты, а процесс уменьшения  – отвод теплоты от рабочего тела.
– отвод теплоты от рабочего тела.
Тепловая энтропийная диаграмма
Наряду с p-v -координатами в термодинамике широко используются T-S -координаты, в которых по оси абсцисс откладывается энтропия. По оси ординат– температура.

 1-2 – произвольный процесс.
1-2 – произвольный процесс.
Площадь элементарного прямоуголь-ника =  .
.
Площадь фигуры под кривой процесса
пл.1-1'-2-2' = 
Таким образом, в T-S координатах площадь под процессов эквивалентна теплу, подводимому или отводимому в процессе.
Изобразим произвольный цикл 1-а-2-b-1.

q1=площадь 1 ' -1-а-2-2 ' – подводимое тепло;
q2 = площадь 1 ' -1-b-2-2 ' – отводимое тепло;
q0=q1-q2= площадь 1-a-2-b-1 -полезное тепло
Тогда
 .
.
Таким образом, к.п.д. цикла пропорционален площади цикла в T-S-координатах.
Основные термодинамические процессы
в T-S-координатах
Для того, чтобы использовать свойства тепловых энтропийных диаграмм, необходимо изображать в T-S-координатах процессы и циклы.
Изохорный процесс (v=const)
Тепло, подводимое в изохорном процессе, можно определить через теплоемкость (в дифференциальном виде):
dq = cv∙dT.
Подставим это выражение в общую формулу для изменения энтропии и проинтегрируем:
 ‚
‚
→ 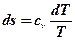 ‚
‚
→ 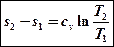
 На основании этого выражения можно изобразить изохорный процесс в T-S-координатах.
На основании этого выражения можно изобразить изохорный процесс в T-S-координатах.
|
Изохора в T-s- коорди-
натах изображается
логарифмической
кривой.
Изобарный процесс (p=const)



Изобара в T-s- координатах изображается логарифмической
кривой, лежащей положе изохоры.
Изотермический процесс (T=const)
Так как все тепло, подводимое в изотермическом процессе, расходуется на совершение работы, определим тепло по формуле для работы:
dq = dl = p∙dv ‚
Из уравнения состояния pv = RT выразим давление  и подставим его в формулу для тепла:
и подставим его в формулу для тепла:
dq = p∙dv =  ‚
‚
Подставим это выражение в общую формулу для изменения энтропии и проинтегрируем:
 →
→
→  →
→
→ 

Сделав замену  , получим еще одну формулу:
, получим еще одну формулу:

Date: 2016-02-19; view: 658; Нарушение авторских прав