
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры трансформации органических соединений
|
|
Способность клеток микроорганизмов к сложнейшим процессам биотрансформации наиболее полно реализовалась при получении промышленно важных стероидов. Использование абсолютной субстратной специфичности и стереоспецифичности биологических катализаторов, присущих целым клеткам микроорганизмов, позволило разработать условия осуществления множества химических реакций для структурных перестроек стероидов. В результате были получены новые соединения с лучшими фармакологическими свойствами.
Биотрансформация стероидов обычно заключается в селективном воздействии на одно из положений стероидного скелета. Первый промышленный процесс микробной биотрансформации стероидов основывался на технологии направленного гидроксилирования (11-α-гидроксилирование) прогестерона:
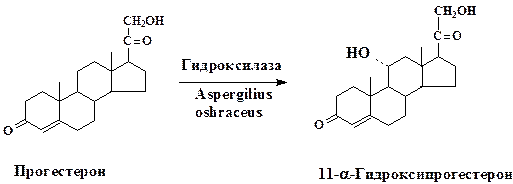
Значимость разработанной микробной трансформации определяется тем, что процессы гидроксилирования кортикостерона и его производных лежат в основе промышленного получения многих ценных продуктов: противовоспалительных и противоопухолевых препаратов, трансквилизато-ров, анестезирующих средств, половых гормонов и пр.
В качестве типичного примера микробиологической трансформации рассмотрим подробнее превращение гидрокортизона в преднизолон культурой Mycobacterium globiforme для которой характерны окислительно-восстановительные превращения стероидной молекулы(микроорганизм применяется в промышленности для получения стероидных гормонов):
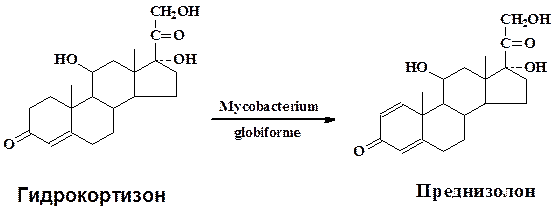
Культуру Mycobacterium globiforme предварительно выращивают на питательной среде содержащей кукурузный экстракт 1,0 г, глюкозу 1 г, агар-агар 3,0 г, на 1 л водопроводной воды при рН среды 6,8-7,2 в течени 4-5 сут. Затем водной суспензией клеток засевают колбы с жидкой средой того же состава, разлитой по 50 мл в медицинские качалочные колбы. Одновременно с бактериальной суспензией вносят в качестве индуктора ацетат кортизона (10 мг в 1 мл метанола на 50 мл среды). Через 24 ч (при сухой биомассе 1,6—2,5 мг/мл) в культуральную жидкость вносят водную суспензию тонкоизмельченного гидрокортизона до величины частиц менее 5мкм. Трансформацию проводят при 28-30 °С на качалке с 200—220 об/мин в течение 18—24 ч. Культуральную жидкость (300 мл) экстрагируют три раза этилацетатом (по 1л), объединенный экстракт упаривают до 300 мл, добавляют 0,3 г активированного угля, кипятят 5-10 мин, уголь отфильтровывают, промывают горячим этилацетатом и растворитель отгоняют до 45 мл. Раствор охлаждают 16 ч при 0 °С для полного выделения преднизолона. Осадок отфильтровывают, промывают охлажденным этилацетатом, высушивают при 60-70 °С. Выход преднизолона 85 % от теоретического, в качестве примесей образуется 20β-оксипроизводное преднизолона (0,5 %) и исходный гидрокортизон – 6-8 %.
При использовании иммобилизованных в полиакриламидный гель клеток Mycobacterium globiforme реакционную смесь, содержащую 0,1 г/л гидрокортизона в фосфатном буфере (рН 7,0), пропускали через колонку, содержащую гранулы геля. Скорость потока через колонку 1,3 мл/ч на 1 мл геля (SV), температура 20-22 °С. Выделение стероидов проводили по методике, описанной выше. При таких условиях наблюдалось количественное превращение субстрата в течение 9-10 сут, через 15 сут активность снижалась на 50%, через 20 сут обнаруживалось лишь 5-7 % превращенного субстрата.
Разработка крупномасштабного производства преднизолона путем биотрансформации стероидов позволила снизить стоимость этого препарата в 200 раз.
Важнейший источник стероидных гормонов - культуры клеток растений. Так, культура клеток диоскореи дельтовидной (Dioscorea deltoided) корневого происхождения продуцирует фитостерин диосгенин и его гликозидные производные (сапонины). Существенно, что способность к сверхсинтезу фуростаноловых гликозидов ряда штаммов диоскореи, например штамма ДМ-ОГ, стабильно поддерживалась в течение 27 лет. Таким образом, культивирование клеток растений in vitro представляет собой новое решение проблемы промышленного получения вторичных метаболитов.
Биотрансформация стероидов с использованием культур растительных клеток имеет целый ряд преимуществ перед микробиологической трансформацией. Так, если трансформация в положения 3 и 5 характерна практически для всех используемых культур (микроорганизмы, растительные клетки), то реакции Iβ-, 4β-, I2β- (дигитоксин в дигоксин), 16β-гидроксилирования и изомеризации 17β-лактонного кольца, осуществляются только некоторыми культурами растительных клеток, и сильно, зависят от происхождения ткани и условий трансформации.
Изучение биотрансформации малоиспользуемого в терапии сердечного гликозида дигитоксина в ценные гликозиды (дигоксин, пурпурео-гликозид А и др.) проводилось на клеточных линиях Digitalis. Высокий выход конечных продуктов был достигнут при селекции специализированных линий и оптимизации условий роста в специальных аппаратах.
Процесс биотрансформации дигитоксина протекал в две стадии. После 10-дневной инкубации клеток Digitalis lanata в “ростовой” питательной среде (Мурасиге - Скуга) культуру переносили в "продукционную” среду (8% раствор глюкозы) с субстратом для биотрансформации- дигитоксином. В этих условиях весь дигитоксин в течение 2 дней трансформировался в дигоксин.
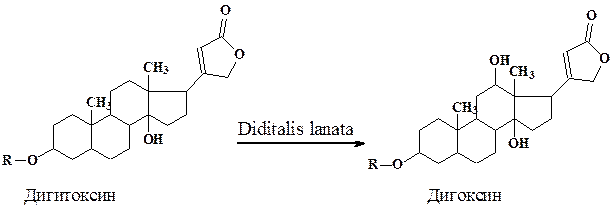
Дальнейшие успехи в производстве стероидных препаратов связывают с применением иммобилизованных клеток, использованием оптимального сочетания биологических и химических превращений, а также с совершенствованием технологии очистки получаемых соединений.
Так, в настоящее время разработаны промышленные способы получения ценных карденолидов, основанные на иммобилизации растительных клеток Digitalis в специальных биокатализаторах.
В последнее время сильно возрос интерес к использованию микроорганизмов для избирательной биотрансформации гетероциклических соединений.
Среди гетероциклических соединений наиболее широко изучены процессы окисления пиридинов в пиридоны, селективное окисление боковых алкильных групп в различных гетероциклах, энантиоселективное цис-дигидроксилирование бензотиофенов и бензофуранов.
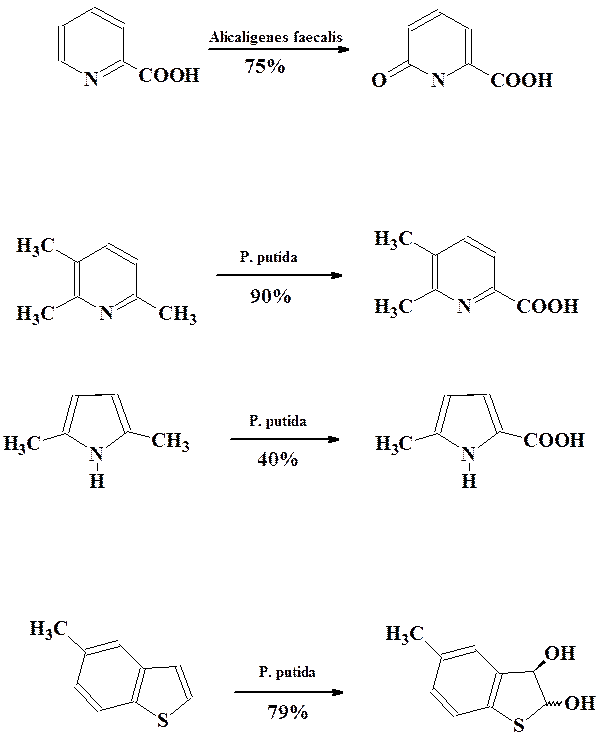
Поразительным примером возможностей микробной биотрансформа-ции является катализируемое ферментами введение аминокислотных фрагментов в 4-, 5-, 6-, 7-азаиндолы при алкилировании их серином.
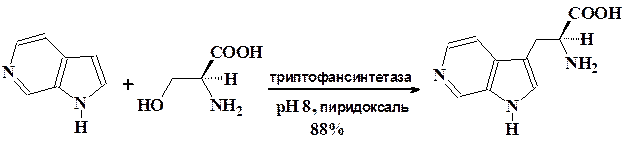
Учеными фирмы “Сетус корпорепйшин” предложен оригинальный ферментативный способ синтеза различных окисей алкенов (эпоксидов), являющихся исходным соединением для синтеза различных пластмасс и производных диолов (антифриз, тормозная жидкость и т.д). В настоящий момент окиси алкенов получают химическим путем. Процесс протекает под высоким давлением, является взрывоопасным и требует большого количества дорогостоящего серебряного катализатора.
Ферментативный синтез окисей алкенов из алкенов, протекающей в водной среде, основан на 3 ферментах: глюкозозо-2-оксидазе из базидомицета Oudemansiella mucida, галопероксидазе из гриба Caldariomyces или других источников и эпоксидазе из Flavobacterium. На первом этапе синтеза глюкозозо-2-оксидаза вызывает образование перекиси водорода (Н2О2) из глюкозы, которая служит и субстратом, и источником энергии. На втором этапе, катализируемом галопероксидазой, перекись водорода взаимодействует с вводимыми в реакционную среду алкеном и галогенид-ионом (ионом фтора, хлора или брома) с образованием соответствующего β-алкангалогенгидрина. На последнем этапе водород гидроксильной (Н+) группы и галогенид-анион отщепляются под действием эпоксидазы, в результате чего получается окись соответствующего алкена.
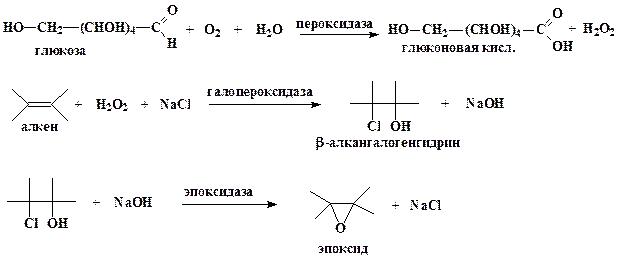
Ферментативный путь синтеза окисей алкенов весьма выгоден с экономической и экологической точек зрения по сравнению с химическим, поскольку источником галогенид-иона может служить обычная соль, такая как хлорид натрия, а в химическом синтезе используют элементарный хлор. Не нужен и серебряный катализатор. При использовании ферментативного метода в качестве побочного продукта с высоким выходом из глюкозы образуется глюконовая кислота, которая в свою очередь является очень ценным продуктам.
Другое преимущество ферментативного способа синтеза окисей алкенов – его гибкость: изменяя субстрат на который действует галопероксидаза, можно синтезировать различные окиси алкенов. Еще одно достоинство этого метода состоит в том, что он не дает отходов: галоген можно опять использовать в новом цикле синтеза. Перспективным является увеличение активности ферментов за счет их иммобилизации или модификации активных центров с использованием методов генной инженерии.
Date: 2016-02-19; view: 708; Нарушение авторских прав