
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры реакций, идущих необратимо
|
|
Ионно-обменные реакции между ионами
В растворах электролитов
Реакции в растворах электролитов протекают между ионами, на которые диссоциируют растворенные вещества. При этом не изменяются степени окисления элементов.
Не все ионные обменные реакции необратимы. Ионные обменные реакции идут до конца в том случае, если в результате реакции образуется:
-нерастворимое соединение, выпадающее в осадок;
-газообразное вещество;
-слабый электролит (вода, слабое основание или слабая кислота).
-- Уравнения реакций такого типа более правильно писать не в молекулярной, а в ионно-молекулярной форме. В этих уравнениях указывают ионы, на которые распадаются молекулы сильных электролитов. Малорастворимые вещества, выделяющиеся из раствора в виде осадка, газообразные соединения и слабые электролиты в этих уравнениях пишут в молекулярном виде. Кроме того, существует краткая ионная форма записи уравнения реакции, отображающая сущность реакции, протекающей в растворе электролита.
Примеры реакций, идущих необратимо
1. Образование осадка
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
- молекулярное уравнение реакции,
Ba2+ + 2Cl- + 2Na+ + SO 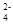 = BaSO4↓ + 2Na+ + 2Cl-
= BaSO4↓ + 2Na+ + 2Cl-
- ионно-молекулярное уравнение реакции,
Ba2+ + SO 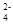 = BaSO4↓ - краткая форма уравнения реакции.
= BaSO4↓ - краткая форма уравнения реакции.
2. Образование газообразного вещества
Na2S + 2HCl = H2S↑ + 2NaCl
- молекулярное уравнение реакции,
2Na+ + S2- + 2H+ + 2Cl- = H2S↑ + 2Na+ + 2Cl-
-ионно-молекулярное уравнение реакции,
2H+ + S2- = H2S↑ - краткая форма уравнения реакции.
3. Образование слабого электролита
а) Воды: 2NaOH + H2SO4 = H2O + Na2SO4 - молекулярное уравнение реакции,
2Na+ + 2OH- + 2H+ +SO 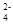 = 2H2O + 2Na+ + SO
= 2H2O + 2Na+ + SO 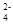
-ионно-молекулярное уравнение реакции,
2OH- + 2H+ = 2H2O - краткая форма уравнения реакции.
Реакция нейтрализации сильной кислоты сильным основанием сводится к взаимодействию ионов водорода с гидроксид-ионами.
б) Слабой кислоты:
2NaNO2 + H2SO4 = 2HNO2 + Na2SO4
- молекулярное уравнение реакции,
2Na+ + 2NO2- + 2H+ + SO 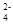 = 2HNO2 + 2Na+ + SO
= 2HNO2 + 2Na+ + SO 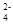
-ионно-молекулярное уравнение реакции,
2H+ + 2NO2- = 2HNO2 - краткая форма уравнения реакции.
Сильные кислоты вытесняют слабые кислоты из их солей.
в) Слабого основания:
NH4Cl + NaOH = NH4OH + NaCl
- молекулярное уравнение реакции,
NH4+ + Cl- + Na+ + OH- = NH4OH + Na+ + Cl-
-ионно-молекулярное уравнение реакции,
NH4+ + OH- = NH4OH - краткая форма уравнения реакции.
Сильные основания вытесняют слабые основания из их солей.
Date: 2015-05-22; view: 671; Нарушение авторских прав