
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основные положения термодинамики. Частные процессы
|
|
Основные понятия и определения
Термодинамическая система - тело или совокупность тел, полностью характеризующихся некоторым набором значений макроскопических параметров.
Термодинамические параметры -физические величины, характеризующие макроскопическое состояние тел. К ним относятся температура Т, давление р, объем V.
Температура (t, 0С; Т, К) - термодинамический параметр характеризующий степень нагретости тел.
Объем (V, м3), удельный объем ( v, м3/кг), молярный объем (v мол, м3/моль) - соответственно, объем всего тела, объем, приходящийся на единицу массы или на один моль вещества.
Давление (р, Н/м2, Па) - термодинамический параметр, характеризующий суммарное импульсное воздействие частиц тела на ограничивающую его поверхность.
Равновесное состояние системы - это, как правило, установившееся состояние системы, которое характеризуется определенным набором численных значений термодинамических параметров. Равновесное состояние системы характеризуется уравнением состояния j (р, Т, V) = 0.
Уравнение состояния системы - функциональная связь между термодинамическими параметрами системы, находящейся в равновесии: р = j(Т, V); Т = f (р, V) или V = f(Т, р).
Идеальный газ - газ, молекулы которого не обладают взаимным притяжением и взаимодействуют между собой соударяясь как абсолютно упругие тела. Реальные газы при сравнительно небольших избыточных давлениях (до 10¸105 Па) разрежены и близки по свойствам к идеальным.
Уравнение состояния идеальных газов. В равновесных состояниях термодинамические параметры идеального газа взаимосвязаны уравнением, известным как уравнение Менделеева-Клапейрона (объединенный газовый закон):
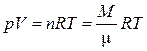 , (1.1.1)
, (1.1.1)
где n - количество киломолей газа,
М - масса газа (кг),
μ - молярная масса газа (кг/кмоль),
R - универсальная газовая постоянная, R = 8314 Дж/(кмоль·К).
Внутренняя энергия системы (U, Дж) - совокупность всех видов энергии в веществах системы, которая является функцией состояния системы. Внутренняя энергия идеального газа зависит только лишь от температуры и обусловлена его кинетической энергией, которая для одного моля равна:
U = (3/2)RТ для одноатомных газов (1.1.2)
U = (5/2)RТ для двухатомных газов (1.1.3)
Равновесный термодинамический процесс - процесс воздействия на систему, при котором изменение состояний системы проходит через равновесные состояния, в которых термодинамические параметры взаимосвязаны уравнением состояния.
Теплота процесса (Q, Дж) - количество энергии, переданной в процессе в микроскопической форме без заметных механических перемещений тел.
Работа процесса (L, Дж) - количество энергии, переданной в процессе в макроскопической форме при заметных механических перемещениях тел.
Первый закон термодинамики -закон сохранения энергии в процессах с участием теплоты. Теплота, подведенная к системе, расходуется на изменение ее внутренней энергии и совершение работы:
Q = 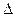 U + L (в интегральной форме), (1.1.4)
U + L (в интегральной форме), (1.1.4)
d Q = dU + d L (в дифференциальной форме) (1.1.5)
Теплота и работа процесса зависят от пути его проведения и не являются функциями состояния системы.
Date: 2015-05-22; view: 482; Нарушение авторских прав