
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Анаболизм аминокислот
|
|
Появление аминокислот (см. Приложение, т.1) в клетке может носить двойной характер. Для основной их части требуется поступление в организм в составе пищевых белков. Если пропорции содержащихся в них аминокислот близки к таковым у человека, то в кишечнике происходит их полное усвоение, поэтому такие протеины называют полноценными; те же аминокислоты, анаболическая фаза носит экзогенный характер, называются незаменимыми (фен, лей, иле, лиз, мет, три, тре, вал). К заменимым относят 8 их аналогов, они могут всасываться в кишечнике после переваривания белков и могут синтезироваться в тканях человека. Для некоторых аминокислот этот процесс очень прост – переаминирование. Таким способом легко получить из


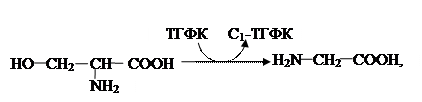 Оригинальны отношения между серином и глицином:
Оригинальны отношения между серином и глицином:
|
где ТГФК – активная форма фолиевой кислоты (витамина Вс).
Восемь заменимых аминокислот (ала, сер, гли, глу, асп и т. д.) легко получаются также при преобразованиях глюкозы и метаболитов гликолиза, ЦТК. Глутаминовая кислота после некоторых реакций может циклизоваться в пролин. Некоторые аминокислоты относят к условно заменимым, т.е. тем, синтез которых зависит строго от конкретных соединений:
Тирозин – продукт гидроксилирования только фенилаланина, аргинин является метаболитом орнитинового цикла синтеза мочевины, цистеин получается из метионина.
2.4. Особенности обмена отдельных аминокислот.
Общим для большинства аминокислот является использование их в генезе белков, поэтому такие представители называют протеиногенными. Но в клетках регистрируются их аналоги, которые не обнаруживаются в полипептидных цепях. Например, орнитин, цитруллин – метаболиты только орнитинового цикла синтеза мочевины, ГАМК – медиатор, гомоцистеин – продукт метаболизма метионина, β–аланин – компонент HSKoA и т.д.
Протеиногенные аминокислоты также, кроме своей вышеназванной основной роли и преобразования в свои аналоги, выполняют специфические, характерные только для них функции. Самый простейший представитель – глицин – служит субстратом в синтезе гема – простетической группы гемопротеидов (гемоглобина, миоглобина, каталазы, пероксидазы, цитохромов), пуриновых оснований (аденина, гуанина – главных компонентов нуклеотидов), включается в состав парных жёлчных кислот (гликохолевой, гликодезоксихолевой кислот), участник генеза креатина, который в мышцах в виде креатинфосфата является макроэргом.
Между глицином и серином существуют тесные взаимоотношения: первая аминокислота, содержащая два углеродных атома с помощью С1-ТГФК легко увеличивается на один атом углерода, преобразуясь в серин последний, в свою очередь, после декарбоксилирования становится этаноламином, который метилируясь дает холин. Все три соединения являются обязательными компонентами липидов: глицеро – и сфингофосфатидов.
В метаболизме аланина особая специфика отсутствует. Он, как и многие другие аминокислоты (глу, асп, сер, фен, тир, гли и др.), может использоваться гликонеогенезе, а один из его метаболитов ДГАФ, восстанавливаясь становится глицерол–1–фосфатом – обязательным компонентом нейтральных жиров и глицерофосфатидов. Образующийся после трансаминирования аланина пируват (основной субстрат в ГНГ) в митохондриях может подвергнуться окислительному декарбоксилированию, продукт которого ацетил-КоА или распадается в ЦТК, или идет на генез кетонового тел, или служит субстратом в синтезе ВЖК либо холестерина, или на реакции ацетилирования (синтез ацетилхолина, ацетилгалактозамина и др.)
Глутамат (или его амид) и аспартат необходимы в орнитиновом цикле мочевины (окончательном обезвреживании NH3), участники синтеза пуриновых, а аспартат – и пиримидиновых нуклеотидов. Глутамат может образовывать циклическую иминокислоту – пролин, аминогруппа глутамина часто используется в реакциях аминирования моносахаридов (в получении глюкозамина, галактозамина и т.д.). Интересно, что глутаминовая кислота, как и глицин способна выполнять функцию нейромедиаторов.
Специфичны преобразования аргинина поступающего или с пищей, или получающегося в орнитиновом цикле синтеза мочевины. Он является обязательным участником синтеза креатина (приложение табл. 8), а также от этой аминокислоты под действием NO – синтазы, может отщепляться радикал ·NO - биологически активная структура, регулирующая сердечные сокращения, тонус сосудов. Подобный эффект, но более длительный, оказывают органические нитропроизводные (нитроглицерин, нитросорбид и т.д.), используемые в клинике сердечно-сосудистых заболеваний.
Из серосодержащих аминокислот заменимой является цистеин, который получается после взаимодействия серина и метионина; включаясь в белки, укрепляет их структуру, за счет образования бисульфидных мостиков (в составе кератина, эластина, коллагена). Входя в активные центры различных ферментов, за счет HS-группы непосредственно участвует в обеспечении каталитической функции. Распад цистеина (приложение, табл. 5) может закончиться образованием таурина и сульфатов. Первый является антиоксидантом. Но выше названное соединение выполняет еще одну функцию, входя в состав парных желчных кислот (таурохолевой, тауродезоксихолевой), облигатных участников переваривания липидов. Необходимый в реакциях ацилирования коэнзим включает в свою молекулу HS-группу, меркаптоэтиламина, получившегося из цистеина. В организме присутствуют энзимы, с помощью которых сульфгидрильная группа последнего окисляется до сульфатов, активная форма которых– ФАФС (фосфоаденозинфосфосульфат) – используется в реакциях сульфирования (получении сульфатированных липидов, гетерополисахаридов), при обезвреживании в печени.
Метиотин – условно заменимая аминокислота: ее основная доля имеет экзогенное происхождение, а небольшой процент получается из гомоцистеина с помощью метионинсинтазы, использующей в качестве донора метильной группы – Н3С-ТГФК (Метил-тетрагидрофолиевую кислоту).
Особая роль принадлежит метионину в синтезе белков. Образование любой полипептидной цепи начинается с этой аминокислоты, но в конце трансляции происходит ее отделение от получившегося протеина, иными словами в клетках регистрируется очень малое количество метионинсодержащих полимеров. Их примером могут быть метионинэнкефалины – «гормоны счастья». С другой стороны, с помощью взаимодействия с АТФ из этой аминокислоты получается макроэрг - SAМ (S-аденозилметионин), который служит источником метильных групп в синтезе креатина, карнитина (с его помощью ацилы ВЖК преодолевают мембраны митохондрий), холина (компонента холинфосфатидов, ацетилхолина), адреналина, ансерина. (приложение, табл. 6, 7).
Схема 9 (см. «Патохимия наследственных болезней» С. 67) обмена серосодержащих аминокислот показывает, как SAМ в результате метилирования преобразуется в S-аденозилгомоцистеин, который гидролизуется до аденозина и S-гомоцистеина. Последний может использоваться или для синтеза метионина, или через цистатионин превращаться в цистеин. Если какая-либо из этих реакций угнетена, происходит накопление этой аминокислоты, что для организма опасно, вызывая ряд патологических эффектов. В последние годы исследователи считают, что гипергомоцистеинемия – более серьёзный фактор риска развития болезней сердечно-сосудистой системы, чем холестерин. Это обусловлено тем, что гомоцистеин повреждает стенки сосудов, делая их поверхность рыхлой, что облегчает осаждение и внедрение холестерина, ионов кальция, образуя атеросклеротическую бляшку. Кроме того, установлено, что данное соединение тормозит работу потивосвертывающей системы, повышение его уровня может быть причиной бесплодия и невынашивания беременности, рождения детей с пороками развития, нарушений когнитивных функций, психических расстройств.
Циклические аминокислоты – в основном, протеиногенные, но служат также и для синтеза других соединений. Фенилаланин и продукт его гидротации тирозин в меланоцитах преобразуются в меланины, защищающие кожу о различных лучевыхпоражений. Из этих же аминокислот синтезируются биологически активные вещества: тироидные гармоны, фенилэтиламин, тирамин, кетохоламины (дофамин, нададреналин, адреналин). Все преобразования в норме и патологии представлены в схеме (Приложение, табл. 8; см. «Патохимия наследственных болезней» С. 60).
Подобная схема (схема 8, см. «Патохимия наследственных болезней» С. 66) иллюстрирует процессы метаболизма триптофана, главным является кинурениновый путь (Приложение, табл. 10), конечными его продуктами служат: НАД+ и НАДФ+ - коферменты дегидрогеназ. Кроме того, триптофан может преобразовываться в следующие биологически активные амины: серотонин, триптамин, мелатонин. О катаболизме гистидина можно судить по схеме 7 (см. «Патохимия наследственных болезней» С. 64).После декарбоксилирования этой аминокислоты получается гистамин – сосудорасширяющее вещество, способствующее боли, воспалительной реакции. Своим присутствием в активном центре ферментов гистидин увеличивает его нуклеофильность (в рибонуклеазе, химотрипсине, фосфолипазе). Кроме того, эта аминокислота входит в состав дипептидов: карнозина и ансерина – АО, предотвращающих поражение функций митохондрий.
Тесты к главам 1, 2.
1. Укажите низкомолекулярные азотсодержащие соединения:
*а) аденин;
*б) гем;
в) рибоза;
*г) глицин;
д) гемоглобин.
2. Укажите эндопептидазы:
*а) трипсин;
б) дипептидаза;
в) рибонуклеаза;
*г) пепсин;
*д) химотрипсин.
3. Для каких ферментов оптимальна щелочная среда:
*а) трипсин;
б) пепсин;
*в) химотрипсин;
*г) эластаза;
*д) карбоксиполипептидаза.
4. Какие ферменты гидролизуют пептидные связи, в образовании которых принимают участие ароматические аминокислоты:
а) трипсин;
*б) пепсин;
в) рибонуклеаза;
*г) химотрипсин;
д) эластаза.
5. Укажите вероятные продукты гниения в кишечнике:
*а) скатол;
б) аденин;
*в) Н2S;
*г) NH3;
*д) путресцин.
6. Физиологические пути всасывания продуктов гидролиза белка в кишечнике:
*а) облегченная диффузия;
б) пиноцитоз;
в) активный транспорт;
г) фильтрация;
д) пассивная диффузия.
7. Происхождение цитоплазматических аминокислот:
*а) результат их всасывания в энтероцитах;
*б) продукт распада тканевых белков;
в) продукт гниения в кишечнике;
*г) синтез из альфа-кетокислот;
д) субстраты синтеза белков.
8. Укажите варианты реакций лишения аминогруппы аминокислотой:
а) декарбоксилирование;
*б) переаминирование;
*в) дезаминирование;
г) аминирование;
д) гидролиз.
9. Укажите возможные продукты дезаминирования аминокислот в клетке:
а) β-оксикислоты;
б) аминоспирты;
*в) α-кетокислоты;
г) ароматические основания;
д) биогенные амины.
10. Укажите витамины, активная форма, которого служит коферментом аминофераз:
а) В1;
б) В2;
в) В3;
г) В5;
*д) В6.
11. Один из вариантов распада каких аминокислот напоминает обмен пирувата:
*а) триптофан;
*б) тирозин;
*в) фенилаланин;
г) пролин;
*д) гистидин.
12. Судьба СО2 в организме:
*а) компонент буферной системы;
б) вхождение в состав витамина В1;
*в) связывание с биотином;
*г) использование в синтезе ВЖК;
*д) выделение из организма.
13. Перечислите биологически активные амины:
*а) гистамин;
б) этаноламин;
*в) фенилэтиламин;
г) глицин;
*д) дофамин.
14. Укажите конечные продукты распада аминокислот:
*а) Н2О;
*б) СО2;
*в) мочевина;
*г) соли аммония;
д) СН4.
15. Укажите аминокислоты – непосредственные участники синтеза мочевины:
*а) асп;
*б) цитруллин;
в) гистидин;
*г) аргинин;
*д) орнитин.
16. Какой метаболит синтеза мочевины отправляется в ЦТК?
*а) аргинин;
б) ОА;
*в) фумарат;
г) малат;
д) глутамат.
17. Где осуществляется орнитиновый цикл синтеза мочевины?
а) в почках;
б) в кишечнике;
в) в головном мозге;
*г) в печени;
д) в мышцах
18. Как называется повышенное содержание мочевины в плазме крови?
а) гиперазотемия;
б) гипокарбамидемия;
в) нормогликемия;
г) гипоазотемия;
*д) гиперкарбамидемия.
19. Укажите варианты гиперазотемии:
*а) продукционная;
б) концентрационная;
*в) ретенционная;
г) фильтрационная;
д) гидролитическая.
20. Перечислите компоненты остаточного азота:
*а) аминокислоты;
*б) мочевина;
*в) соли аммония;
*г) креатин;
д) лактат.
21. Укажите аминокислоты, способные синтезироваться в организме:
а) лей;
*б) сер;
*в) арг;
г) три;
*д) асп.
22. Из каких соединений синтезируются аминокислоты:
а) β-кетокислоты;
*б) α-аминокислоты;
в) ВЖК;
*г) α-кетокислоты;
д) ацетил - КоА.
23. Укажите аминокислоты, которые не являются протеиногенными:
*а) орнитин;
*б) гомоцистеин;
*в) цитруллин;
г) аспарагин;
д) аланин.
24. Какая аминокислота является компонентом парных желчных кислот:
а) ала;
б) гистидин;
*в) гли;
г) аспарагин;
д) серин.
25. Какие аминокислоты – участники синтеза креатина:
а) орнитин;
*б) аргинин;
*в) глицин;
*г) метионин;
д) лейцин.
26. Какая аминокислота включается в гем?
а) треонин;
б) гистидин;
в) аланин;
*г) глицин;
д) аргинин.
27. Избыточная концентрация в крови какой аминокислоты является фактором риска патологии сердечно-сосудистой системы:
а) треонина;
б) метионина;
в) цистеина;
г) цистина;
*д) гомоцистеина.
28. Преобразование какой аминокислоты заканчивается образованием НАДФ?
а) глобулина;
б) аргинина;
в) карнитина;
*г) триптофана;
д) тирозина.
29. Какие соединения могут синтезироваться из фенилаланина?
*а) тироксин;
*б) меланин;
*в) адреналин;
*г) фенилэтиламин;
д) пролин.
30. Блок какого фермента характерен для фенилкетонурии?
а) дофамингидроксилаза;
б) тир-аминофераза;
*в) фенилаланин-4-гидроксилаза;
г) фенилаланин-аминофераза;
д) фенилаланин-ДГ.
31. Генетический дефект в обмене какой аминокислоты приводит к развитию синдрома Хартнупа?
а) гистидина;
*б) триптофана;
в) тирозина;
г) метионина;
д) аспартата.
32. Какое вещество выделяется с мочой при алкаптонурии?
а) фумарат;
б) таурин;
*в) гомогентизинат;
г) фениллактат;
д) пируват.
33. Укажите варианты наследственной патологии триптофана:
а) олигофрения фенилпирувика;
*б) синдром Прайса;
*в) синдром Кнаппа– Комровера;
*г) синдром голубых пеленок;
д) синдром Леш-Найхана.
Date: 2015-05-22; view: 726; Нарушение авторских прав