
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Катаболизм (распад) основных пищевых веществ - углеводов, жиров, белков (аминокислот)
|
|
В системе пищеварения основные классы молекул - белки, липиды и углеводы подвергаются ферментативному гидролизу и расщепляются до аминокислот, жирных кислот и глицерола, а также аминокислот соответственно. После их всасывания, транспорта и распределения по всем клеткам организма начинаются специфические пути катаболизма. Специфические пути катаболизма Жирные кислоты в процессе |3-окисления (в митохондриях) превращаются в ацетил-КоА. Глицерол через стадию глицеральдегида превращается в глицеральдегид-3-фосфат и поступает в гликолиз. Моносахариды, поступая в клетку, преобразуются в форму глюкозы, а затем вступают в гликолиз в цитозоле.
Аминокислоты, после удаления аминогруппы, превращаются в кето-кислоты. Первая реакция распада аминокислот это отделение аминогруппы. Часть аминокислот (1) затем превращается в пируват (они называются гликогенные), часть в молекулу ацетил-КоА (2) (они называются кетогенные) и промежуточные продукты цикла трикарбоновых кислот (3). Специфическими путями катаболизма называют внутриклеточное превращение жирных кислот, моносахаров и аминокислот в универсальные молекулы пирувата и ацетил-КоА. Общий путь катаболизма. Этот путь начинается с пирувата, который превращается в молекулу ацетил-КоА под действием сложного мультифетментного пируватдегидрогеназного комплекса в митохондриях.
Затем молекула ацетил-КоА подвергается полному окислению в цикле трикарбоновых кислот, где из неё извлекаются высокоэнергетические электроны. Эти электроны в составе молекул НАДН и ФАДН2 вовлекаются
Особенностью ферментов и белков комплекса является то, что все ферменты и белковые компоненты мультиферментного комплекса кодируются в ядерной ДНК и синтезируются в цитозоле. После их поступления в митохондриальный матрикс (при этом затрачивается энергия АТФ и протонного градиента) они подвергаются финальному фолдингу с помощью митохондриальных шаперонов, приобретают функциональную активность и объединяются в мультиферментный комплекс.
Последовательность реакций в пируватдегидрогеназном комплексе. В этом комплексе происходит преобразование пирувата в ацетил-КоА, содержащего макро-эргическую тиоэфирную связь и удаление из пирувата 2-х высокоэнергетических электронов в составе молекулы НАДН.
Для превращения пирувата в ацетил-КоА необходимы 5 реакций (1-5 на рис.3). 1. Реакция декарбоксилирования пирувата.
Значение декарбоксилирования пирувата в отношении извлечения энергии из молекулы исключительно велико. Три углеродных атома пирувата имеют разную степень окисления. Углерод метильной группы (-СНз) не окислен и, следовательно, в дальнейшем при его окислении можно получить полезную энергию. Углерод кето-группы (>С=О) окислен частично. При его дальнейшем окислении можно также извлечь некоторое количество дополнительной энергии. А углерод карбоксильной группы окислен почти полностью. Поэтому карбоксильная группа это до некоторой степени балластная часть молекулы с позиции извлечения энергии. Её необходимо удалить. Удаление карбоксильной группы (т.е. реакцию декарбоксилирования) катализирует фермент пируватдегидрогеназа в активном центре которого локализован тиаминдифосфат - кофермент декарбоксилирования.
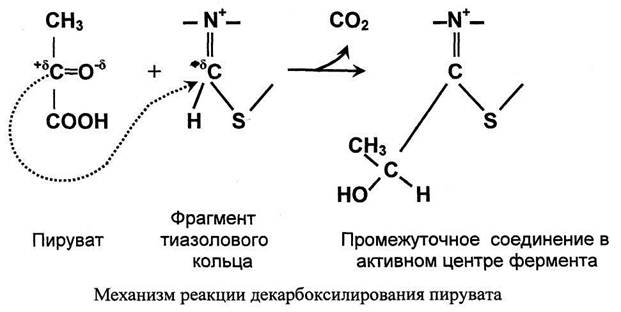
1. В активном центре фермента происходит прямое взаимодействие двух атомов углерода с образованием между ними ковалентной связи. Это взаимодействие обусловлено частичными разноименными зарядами, которыми обладают углерод кето-группы пирувата с одной стороны и атом углерода тиазолового кольца тиа-минпирофосфата с другой.
2. На этой стадии Ei (пируватдегидрогеназа) переносит атом водорода и двухуг-
леролеродный ацетильный фрагмент (СН3-СО-) на молекулу липоевой кислоты,
локализованную в активном центре фермента Е2 (дигидролипоамидацетилтранс-
феразы). При этом в активном центре фермента образуется ацетилтиоэфир липое
вой кислоты.
3. В этой реакции KoA-SH атакует тиоэфирную связь в активном центре фермента
Е2, разрывает её и присоединяет к себе двухуглеролеродный ацетильный фраг
мент (СНз-СО-). Происходит образование ацетил~КоА, который покидает актив
ный центр фермента Е2 (дигидролипоамидацетилтрансферазы). При этом оба ато
ма серы липоевой кислоты полностью восстановлены.
4. В этой реакции фермент Е3 (дигидролипоамиддегидрогеназа) катализирует пе
ренос двух атомов водорода с восстановленной липоевой кислоты, находящейся в
активном центре фермента Е2 на кофермент ФАД, локализованный в своём актив
ном центре. При этом в активном центре фермента Е3 образуется ФАДН2.
5. В активный центр дегидрогеназы (Е3) пируватдегидрогеназного комплекса вхо
дит НАД+ и присоединяет к себе 2 электрона и протон от кофермента ФАДН2 и в
форме НАДН переносит их в процесс окислительного фосфорилирования.
Date: 2015-05-22; view: 2116; Нарушение авторских прав