
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Специфические свойства кислот
|
|
1.Некоторые кислоты разлагаются при нагревании:
| t0 t0 |
  H2SiO3 H2O + SiO2↓ H2CO3 H2O + CO2↑ H2SiO3 H2O + SiO2↓ H2CO3 H2O + CO2↑
|
(угольная кислота существуют только в растворе)
| H2SO3 = SO2↑ + H2O 4HNO3 = 4NO2 + O2 + 2H2O |
| 3HNO2 = HNO3 + 2NO + H2O 2HNO2 = NO2 + NO + H2O |
| 3HClO = 2HCl + HClO3 4H3PO3 = 3H3PO4 + PH3 |
Устойчивы к нагреванию только H2SO4 и H3PO4. Ортофосфорная кислота H3PO4 при длительном кипячении переходит сначала в дифосфорную, а затем в метафосфорную кислоту:
| 2H3PO4 = H4P2O7 + H2O H4P2O7 = 2HPO3 + H2O |
2. При взаимодействии кислот с неметаллами (азотная и концентрированная серная кислота – сильные окислители, сероводородная и иодоводородная – сильные восстановители).
| S + 6HNO3(конц.) = H2SO4 + 6NO2↑ + 2H2O |
| C + 5HNO3(конц.) = 4NO2 + CO2↑ + H2O |
| P + 5HNO3(конц.) = HPO3 + 5NO2 ↑ + 2H2O |
| S + 2HNO3(разб.) = H2SO4 + 2NO↑ |
| P + HNO3(разб.) + 2H2O = 3H3PO4 + 5NO↑ |
| C + 2H2SO4(конц.) = 2SO2↑ + CO2↑ + 2H2O |
При действии кислоты, обладающей сильными восстановительными свойствами на неметалл, последний восстанавливается до соответствующей кислоты, а кислота, взятая для реакции, обычно окисляется до неметалла, образующего эту кислоту. Возможны и другие продукты реакции:
| H2S + Cl2 = 2HCl + S↓ (кроме F2) |
| H2SO3 + Cl2 + H2O = H2SO4 + 2HCl (кроме F2) |
| 2H2S+ O2 = 2S↓ + 2H2O |
| 2H2S(г) + 3O2 = 2SO2 + 2H2O |
| 2HBr + Cl2 = 2HCl + Br2↓ |
Более активные галогены (активность галогенов падает в ряду F2, Cl2, Br2, I2) вытесняют (восстанавливают) менее активные из кислот типа НF (исключение составляет фтор, который в растворе реагирует не с кислотой, а с водой):
| 2HBr + Cl2 = 2HCl + Br2↓ 2HI + Cl2 = 2HCl + I2↓ |
| 2HI + Br2 = 2HBr + I2↓ |
3.Взаимодействие серной кислоты с металлами (кроме Au, Pt, Os, Ta, Ir):
1) Металлы, стоящие в ряду напряжений до водорода:
 2H2SO4(разб.) + Cu CuSO4 + 2H2О↑ + SO2
2H2SO4(разб.) + Cu CuSO4 + 2H2О↑ + SO2
2) Щелочные металлы и Zn, Mg:
 2 H2SO4(конц.) + Zn ZnSO4 + SO2↑ + 2H2O
2 H2SO4(конц.) + Zn ZnSO4 + SO2↑ + 2H2O
3) Щелочноземельные металлы и Zn, Mg:
 2H2SO4(конц.) + Mg MgSO4+ SO2↑ + H2O
2H2SO4(конц.) + Mg MgSO4+ SO2↑ + H2O
4) Тяжелые металлы (Pb, Cu, Ni, Zn, Cd, Co, Sb, Sn, Bi, Hg, Ag) и Fe:
 Pb + 2H2SO4(конц.) Pb 2+SO4+ SO2↑ + 2H2O
Pb + 2H2SO4(конц.) Pb 2+SO4+ SO2↑ + 2H2O
5) Al, Co, Fe, Ni и Cr на холоде с концентрированной серной кислотой не взаимодействуют (холодная концентрированная кислота пассивирует эти металлы). Поэтому эти реакции происходят при нагревании.
| t0 |
 6H2SO4(70%) + 2Al Al2(SO4)3 + 3SO2↑ +6 H2O 6H2SO4(70%) + 2Al Al2(SO4)3 + 3SO2↑ +6 H2O
|
| 6H2SO4(70%) + 2Fe = Fe2(SO4)3 + 3SO2↑ + 6H2O |
| t0 |
 H2SO4(конц.) + Cr Cr2(SO4)n + SO2↑ + H2O H2SO4(конц.) + Cr Cr2(SO4)n + SO2↑ + H2O
|
4.Взаимодействие азотной кислоты с металлами (кроме Au, Pt, Os, Ta, и Ir):
1) Щелочные и щелочноземельные металлы:
 4HNO3(конц.) + Cu Cu (NO3)2 +2 H2O + 2NO2↑ 4HNO3(конц.) + Cu Cu (NO3)2 +2 H2O + 2NO2↑
|
 10HNO3(разб.) + 4Zn 4Zn (NO3)n2 + NH4NO3 +3 H2O 10HNO3(разб.) + 4Zn 4Zn (NO3)n2 + NH4NO3 +3 H2O
|
2) Тяжелые металлы и Fe:
 4HNO3(конц.) + Fe Fe(NO3)3 + NO2↑ +2H2O 4HNO3(конц.) + Fe Fe(NO3)3 + NO2↑ +2H2O
|
Железо реагирует с концентрированной азотной кислотой только при нагревании.
t0
 6HNO3(конц.) + Fe Fe3+(NO3)3 + 3NO2↑ + 3H2O
6HNO3(конц.) + Fe Fe3+(NO3)3 + 3NO2↑ + 3H2O
t0
 4HNO3(разб.) + Fe Fe3+(NO3)3 + NO↑ + 2H2O
4HNO3(разб.) + Fe Fe3+(NO3)3 + NO↑ + 2H2O
3) Mg, Zn:
 10HNO3(конц.) + 4Mg 4Mg (NO3)2 + NO↑ + 5H2O 10HNO3(конц.) + 4Mg 4Mg (NO3)2 + NO↑ + 5H2O
|
 8HNO3(разб.) +3Zn 3Zn(NO3)2 + 2NO2↑ + 4H2O 8HNO3(разб.) +3Zn 3Zn(NO3)2 + 2NO2↑ + 4H2O
|
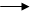 8HNO3(очень разб.) + 3Cu 3Cu(NO3)2 + 2NO2↑ + 4H2O 8HNO3(очень разб.) + 3Cu 3Cu(NO3)2 + 2NO2↑ + 4H2O
|
4) Al, Co, Fe, Ni и Cr на холоде с концентрированной азотной кислотой не взаимодействуют, но при нагревании реакция идет.
| t0 |
 6HNO3(конц.) + Al Al(NO3)3 + 3NO2↑ + 3H2O 6HNO3(конц.) + Al Al(NO3)3 + 3NO2↑ + 3H2O
|
5) HNO3(конц.) при смешивании с HCl(конц.) в соотношении 1:3 по объему, образует раствор, называемый «царской водкой», в котором растворяются Au, Pt и др. металлы:
| HNO3 + 3HCl + Au = AuCl3 +NO↑ + 2H2O |
| 4 HNO3 + 18 HCl + Pt = 3H2[PtCl6] + 4NO↑ + 8H2O |
5. Возможны реакции между кислотами, обладающими сильными окислительными свойствами и кислотами, обладающими сильными восстановительными свойствами:
| H2SO4(конц.) + 2HBr = Br2↓ + SO2↑ + 2H2O |
| H2SO4(конц.) + 8HI= 4I2↓ + H2S↑ + 4H2O |
| H2SO4(конц.) + HCl ≠ H2SO4(конц.) + HF ≠ |
| H2SO4(конц.) + H2S = S↓ + SO2↑ + 2H2O |
| 3H2SO4(конц.) + H2S = 4SO2 + 4H2O H2SO4(конц.) + 2H2S = 3S↓ +3H2O |
| 8HNO3 + H2S = H2SO4 + 8NO2↑ + 4H2O |
Date: 2015-05-22; view: 2405; Нарушение авторских прав