
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Атом водорода по Рзерфорду-Бору
|
|
1. Первая модель строения атома - модель Томсона (1903 г.). Атом представляет собой равномерно заполненный положительным зарядом шар, внутри которого находятся электроны в равновесном состоянии. Эта модель не удовлетворяла физику по многим вопросам, поэтому продолжались поиски других моделей.
2. Вторая модель – модель строения атома Резерфорда предложена на основе опытов по рассеянию a-частиц. Атом состоит из положительно заряженного ядра, вокруг которого по замкнутым орбитам движутся 3. Планетарная модель атома не соответствовала законам классической физики. Н.Бор сформулировал постулаты и правило отбора, которые позволяли объяснить стабильность атомов и линейчатый характер спектров этих атомов.
1 постулат Бора: атомы и атомные системы могут длительное время находиться в определенных стационарных состояниях, не излучая и не поглощая энергию. Энергии этих состояний составляют дискретный ряд значений Е1, Е2, Е3,... Еn.
2 постулат Бора: при переходе атома из одного состояния Еn в другое Еm поглощается или излучается квант энергии
hn= Еn –Еm.
Правило отбора: из всех возможных состояний в атоме реализуются только те, для которых момент импульса электронов (mvr) кратен постоянной Планка (отнесенной к 2p):
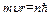
где n=1,2,...- главное квантовое число.
3. Спектр атома водорода линейчатый. При этом группы линий образуют серии в ультрафиолетовой, видимой и инфракрасной областях спектра. Длины волн этих линий можно определить по обобщенной формуле Бальмера: 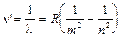 ,
,
где n ‘-волновое число, R=1,09.107м-1 - постоянная Ридберга, m=1,2,...; n=m+1, m+2,.... При m=1 - серия Лаймана, m=2 - серия Бальмера, m=3 - серия Пашена, m=4 - серия Брэкета, m=5 - серия Пфунда.
5. Элементарная теория атома водорода. Электрон в атоме водорода движется вокруг ядра (протона). Радиусы стационарных орбит электрона:
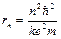 .
.
При n=1 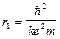 – радиус первой боровской орбиты: r 1=0,53
– радиус первой боровской орбиты: r 1=0,53  .
.
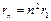 .
.
Энергии стационарных состояний атома водорода:
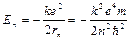 .
.
При n=1 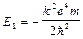 – энергия основного состояния. Еn=E1/n2.
– энергия основного состояния. Еn=E1/n2.
E1=–21,9.10-19Дж=–13,6 эВ, E2=–13,6/4=–3,4 эВ,
E3=–13,6 / 9=-1,5 эВ, E4=–13,6 / 16=–0,85 эВ,
E5=–13,6 / 25=-0,545 эВ.
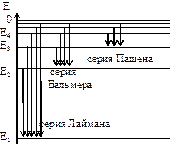
|
6. Схема энергетических уровней атома водорода.
На диаграмме показано происхождение различных серий спектра. Тип серии определяется главным квантовым числом n энергетического уровня, на который происходит переход.
Date: 2015-05-19; view: 914; Нарушение авторских прав