
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Подбор антикоагулянтов
|
|
Материалом для коагулологических исследований является плазма (рис. 69).
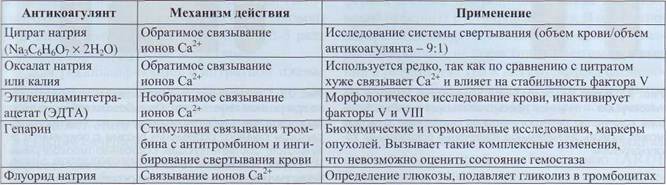
Для получения плазмы или крови для лабораторных исследований используют противосвер-тывающие вещества (табл. 11). Согласно стандарту для производителей DIN ISO Standard 6710 коммерческие пробирки с антикоагулянтом метятся цветом крышки: пробирки с ЭДТА закрыты крышкой светло-лилового (лаванды) цвета, пробирки с гепарином - зеленой, пробирки с цитратом - синей крышкой.
Трехзамещенный цитрат натрия обладает специфической способностью стабилизировать
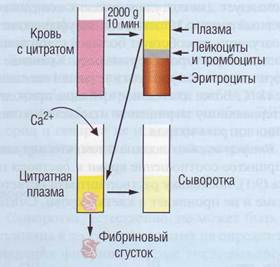
Рис. 69. Получение фракций крови для проведения коагулологических исследований
лабильные факторы свертывания (V и VIII). Цитратная плазма, обогащенная тромбоцитами, используется для изучения их агрегации. В связи с этим цитрат натрия является антикоагулянтом выбора для коагулологических исследований. В соответствии с рекомендацией ВОЗ концентрация цитрата должна быть 109 ммоль.
Кровь смешивают с 3,8% раствором цитрата натрия в соотношении 9:1. На этом этапе могут быть допущены три ошибки.
Первая ошибка - неточность приготовления раствора стабилизатора. Важно учесть, что трехзамещенный 5,5-водный цитрат натрия готовится в концентрации 3,8% (0,11 моль), а 2-водный - в концентрации 3,2%) (0,11 моль). Американский Комитет Стандартизации Клинических Лабораторий
Применение и механизм действия антикоагулянтов
Таблица 11
|
Обеспечение диагностики нарушений гемостаза в КДЛ
рекомендует для коагулологических исследовании буферный раствор 3,2% цитрата. Забуферивание антикоагулянта способствует большей стабилизации лабильных факторов свертывания. Хранение раствора цитрата допускается в течение 1 недели при +2...+8 °С. Более длительное хранение приводит к бактериальному загрязнению и снижению концентрации цитрата натрия.
Вторая ошибка связана с тем, что нарушается принятое соотношение крови и раствора цитрата (9:1), поскольку раствор цитрата остается в плазме и не проникает в клетки крови. Считает-
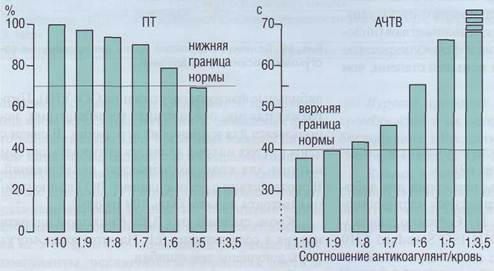
ся, что в пределах разведения крови цитратом 9:1 и 12:1 практически нет различий в результатах коагулологических тестов. Большее количество антикоагулянта по отношению к плазме может вызвать удлинение ПВ и АЧТВ (рис. 70).
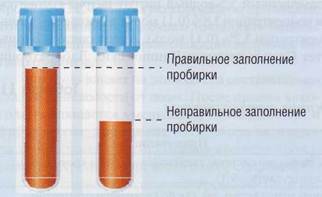
Такая ситуация может возникнуть, когда в приготовленную заранее пробирку с цитратом набрано слишком мало крови (рис. 71).
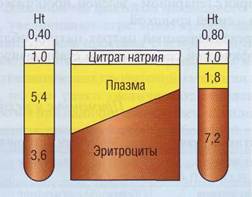
Аналогичная ситуация возникает при разном гематокрите (рис. 72): гематокрит в пределах между 0,25-0,55 (25-55%) несущественно влияет на результаты, при гематокрите свыше 60%
|
Рис. 70. Влияние разведения крови антикоагулянтом на протромбиновый тест (ПТ) и активированное частичное тромбопластино-вое время (АЧТВ), Разведение крови антикоагулянтом сопровождается удлинением ПВ (снижение ПТ) и АЧТВ, при разведении меньшем, чем 8:1, это приводит к регистрации ложноположи-тельного результата
|
|
Рис. 71. Взято недостаточное количество крови в антикоагулянт - типичная преаналитическая ошибка. Большее количество антикоагулянта по отношению к плазме может вызвать значительное изменение показателей ко-агулограммы
Рис. 72. Соотношение объема плазмы и раствора цитрата при разном гематокрите. При высоком гематокрите создаются условия избыточного количества антикоагулянта и слишком сильного разведения плазмы с получением результатов, соответствующих состоянию гипокоагуляции. Наоборот, при низком гематокрите есть высокая вероятность регистрации «ложной» гиперкоагуляции
Обеспечение диагностики нарушений гемостаза в КДЛ
создается избыточная концентрация цитрата в плазме, приводящая к «ложной» гипокоагуля-ции. Напротив, при снижении гематокрита (ниже 25%) обнаруживается «ложная» гиперкоагуляция, кровь при смешивании с цитратом в отношении 9:1 может свернуться в пробирке еще до исследования. Высокий гематокрит - физиологическая характеристика крови новорожденных, у взрослых высокий гематокрит возникает при полицитемиях (эритремиях), сердечной недостаточности.
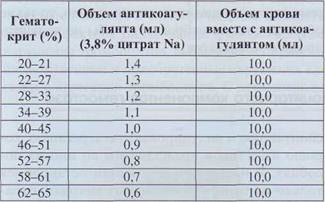
Перерасчет объема стабилизатора в соответствии с гематокритным показателем позволяет избежать этой ошибки (табл. 12). Если же у больного нет значительного сгущения крови или, наоборот, анемизации, приемлемо стандартное соотношение крови и цитрата (9:1).
Таблица 12
Соотношение объема антикоагулянта и венозной крови для постановки коагулограммы
Третья ошибка. Наиболее частой погрешностью при взятии крови является плохое или недостаточное перемешивание ее со стабилизатором. Для предотвращения этого требуется немедленно после заполнения пробирки кровью до требуемого объема закрыть ее крышкой (не резиновой) или чистой полиэтиленовой пленкой и 2-3 раза медленно перевернуть (не встряхивая).
Для рекальцификации к цитратной плазме добавляют определенное количество хлорида кальция. Причиной изменения времени свертывания может стать несоответствие добавляемого кальция содержанию цитрата: коагулологи-ческие исследования являются более чувствительными к избытку кальция в плазме (высокий
гематокрит, слишком мало крови), чем к его недостатку (низкий гематокрит, слишком много крови).
Для некоторых тестов рекомендуются специальные антикоагулянты. При исследовании функции тромбоцитов практически любой антикоагулянт может быть источником ошибок. ЭДТА, флуорид и гепарин не используются при проведении традиционных тестов коагулограммы.
Сыворотка
Сыворотка, естественно, не может быть использована в тестах, основанных на определении выпадения фибрина. Кроме того, сыворотка практически не содержит факторов II, V, VIII и XIII, которые удаляются со сгустком, в сыворотке частично сохраняются ф.VII, -IX, -X и -XII. Сыворотку можно использовать для исследования некоторых компонентов, на определение которых оказывают интерферирующий эффект компоненты плазмы, в частности, в сыворотке можно определять содержание продуктов деградации фибрина/фибриногена (ПДФ).
Хранение и центрифугирование
Кровь в пробирке необходимо тщательно перемешать, перевертывая пробирку, при этом не допускается образования пены. Нельзя трясти пробу, так как это может вызвать денатурацию белков и активацию тромбоцитов.
Сразу же после взятия крови происходит изменение активности компонентов системы свертывания и фибринолиза. В пробе, не закрытой пробкой, возрастает рН из-за потери СО2. Следствием этого является увеличение времени свертывания. На стабильность рН пробы влияет буферная система эритроцитов, а также использование буферных растворов цитрата. В пробе крови, хранящейся при комнатной температуре и закрытой пробкой, не происходит заметных изменений в результатах ПВ и АЧТВ. Эффект физиологического забуферивания за счет эритроцитов исчезает в открытой пробирке при попадании в нее атмосферного воздуха.
Согласно международным рекомендациям срок доставки проб в лабораторию (ARUP Laboratories, 2002) для исследования показате-
Обеспечение диагностики нарушений гемостаза в КДЛ
лей гемостаза не должен превышать 45 минут
после взятия крови у пациента. Стабилизированную кровь до центрифугирования (в том числе и в процессе транспортировки) хранят при комнатной температуре (+18... +25 °С). Транспортировка крови на большие расстояния и ее частое встряхивание искажают результаты исследования. Кровь нельзя хранить во льду (что делается в некоторых клиниках), так как это может привести к холодовой активации фактора XII (процесс запускается через контактную фазу и развивается достаточно часто) и вызвать значительные изменения функции тромбоцитов.
Центрифугирование для получения плазмы должно проводиться при ускорении 1500-2000 g в течение 10 минут, при этом получается плазма, «бедная» тромбоцитами. Если пробы необходимо заморозить перед проведением теста, то после размораживания рекомендуется повторно от-центрифугировать пробу и работать с суперна-тантом. Это делается для удаления остатков разрушенных тромбоцитов, фосфолипидов и белков их мембран, которые могут влиять на некоторые коагуляционные тесты.
Проверка исследуемых образцов перед выполнением тестов
Проверка образцов крови или плазмы перед проведением коагуляционных тестов позволяет избежать многих ошибок, связанных с преанали-тическими погрешностями.
Неправильное соотношение кровь/цитрат можно определить, если объем крови в пробирке меньше или больше, чем требуемый. При малом объеме крови будет зарегистрировано ложное удлинение коагуляционных тестов.
Пробы с видимыми сгустками фибрина. В зависимости от степени свертывания коагуляционные тесты могут быть укорочены, нормальны или удлинены.
Гемолиз может произойти при хранении не-отцентрифугированной крови или после центрифугирования. В таких тестах результаты варьируют в зависимости от степени гемолиза. Если гемолиз присущ in vivo, что подтверждается взятием нового образца, то тесты могут выполняться для оценки гемостатической ситуации. Если гемолиз произошел после взятия крови, то такие образцы следует отбросить, чтобы не получить ложных результатов.
Тесты для оценки сосудистого и тромбоцитарного компонентов гемостаза
Традиционные тесты на исследование сосудистого и тромбоцитарного компонентов гемостаза, в том числе пробы на резистентность (ломкость) капилляров, пробы на длительность и величину капиллярного кровотечения, подсчет тромбоцитов в камере, изучение размеров тромбоцитов в мазке, визуальные методы на
.
спонтанную и индуцированную агриегацю, хорошо известны и представлены во многих пособиях. В настоящем изложении остановимся только на относительно новых методах, отработанных на новой лабораторной технике, поступающей в клинико-диагностические лаборатории.
Время кровотечения
Время кровотечения - это время от момента нанесения стандартной раны кожи до момента прекращения вытекания крови. Оно характеризует функциональную активность тромбоцитов и взаимодействие тромбоцитов с сосудистой стенкой. Время кровотечения не выявляет всех тром-боцитарных нарушений (такого метода вообще не существует), этот скрининговый тест позволяет заподозрить тромбоцитопатии различного ге-
неза, болезнь Виллебранда и нарушения проаг-регантных свойств сосудистой стенки. После выявления патологии нет необходимости повторять это исследование, нужно использовать более чувствительные и специфичные методы. У этого метода есть серьезные недостатки: Метод плохо стандартизуется. Результаты
теста позволяют лишь предположить наличие
тех или иных нарушений.
Обеспечение диагностики нарушений гемостаза в КДЛ
Низкая чувствительность. Отсутствие удлинения времени кровотечения не всегда позволяет исключить нарушения тромбоцитарно-го или сосудистого звеньев гемостаза. Низкая специфичность не позволяет однозначно интерпретировать результаты метода.
Однако это наиболее доступный метод для выявления нарушений взаимодействия тромбоцитов с сосудистой стенкой. Кроме того, это дешевый метод, позволяющий заподозрить нарушения соответствующего звена гемостаза и решить вопрос о необходимости дальнейших углубленных исследований.
Date: 2015-05-19; view: 672; Нарушение авторских прав