
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Современная теория свертывания крови
|
|
Разработанная и дополненная в начале - середине XX века теория гемостаза базировалась на исследованиях, выполненных in vitro, и не учитывала реальные условия в системе кровообращения. В последнее десятилетие под давлением накопившихся фактов взгляд на механизмы гемостатических реакций изменился. Наиболее значимым шагом явилась разработка каскадно-матрич-ной теории свертывания крови, в которой учтены не только реакции взаимодействия белков плазмы и тромбоцитов, но влияние компонентов сосудистой стенки и других клеток крови. Реакции гемостаза привязали к конкретным структурам на мембранах клеток и субэндотелия. Были учтены особенности мембранных рецепторов клеточных компонентов гемостаза и микроокружения, в котором происходят реакции.
На рис. 64 представлена последовательность гемостатических реакций. Однако эта схема отражает проблему на феноменологическом уровне. Видимо, в организме запуск всех процессов происходит в течение нескольких секунд после возникновения травмы, но каждый процесс име-
ет различную скорость развития. При этом различные внешние воздействия и особенности организма могут менять соотношение скоростей разных гемостатических реакций.
Сложно подробно описать весь комплекс реакций гемостаза, привязываясь к динамике процесса, поэтому мы опишем лишь важнейшие моменты. Более подробная информация была дана ранее в разделах, посвященных конкретным системам. Тем не менее целостное представление необходимо для правильной клинической интерпретации лабораторных тестов.
В первый момент после повреждения сосуда развиваются следующие реакции:
• Вазоконстрикция (в сосудах, имеющих мы
шечный слой). Она механически ограничива
ет кровопотерю, создает условия для более
эффективного тромбоцитарного гемостаза и
позволяет теснее сопрягать гемостатические
реакции в зоне повреждения.
• Активация эндотелиоцитов с последующим
экзоцитозом под воздействием стимуляторов:
тромбина, гистамина, фибрина, компонентов

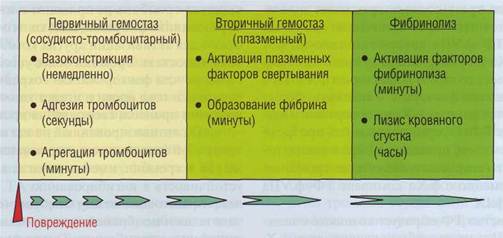
Рис. 64. Последовательность развития гемостатических реакций в системе кровотока после повреждения сосудистой стенки
Современная теория свертывания крови
комплемента, гипоксии. Экзоцитоз содержимого пулов хранения эндотелиоцитов приводит к локальному повышению концентрации про-коагулянтов, в первую очередь фактора Вил-лебранда. Видимо, на поверхности активированных эндотелиоцитов появляется тканевой фактор. Таким образом, антикоагулянтные свойства эндотелия сменяются на прокоагулянт-
ные в зоне повреждения. Однако прокоагулянт-ный потенциал уменьшается по мере удаления от области повреждения и меняется на анти-коагулянтный в области интактного эндотелия. Немедленно после повреждения происходит контакт крови с субэндотелиальными структурами и развиваются события, которые описывает каскадно-матричная теория свертывания крови.
Каскадно-матричная теория свертывания крови
В настоящее время имеются доказательства того, что в условиях in vivo внутренний и внешний пути активации протромбиназы взаимосвязаны. Комплекс ТФ-ф.VIIа активирует фактор IX, а факторы ХIIа и Ха могут активировать фактор VII. Кроме того, оказалось, что, несмотря на сходную структуру мембранных липидов, клетки, несущие тканевой фактор, и активированные тромбоциты экспрессируют рецепторы, которые локализуют на их поверхности различные компоненты свертывающей системы крови.
Условно процесс свертывания крови можно разделить на три перекрывающих друг друга фазы.
1-я фаза - инициация процесса свертывания крови. Сразу же после повреждения эндотелия кровь контактирует с матриксом субэндотелия и клетками субэндотелия (фибробластами, макрофагами, гладкими мышечными клетками). ТФ, фиксированный на мембране этих клеток, образует комплекс с плазменным ф.VII. Поскольку около 1% ф.VII присутствует в кровотоке в активной форме, сразу после повреждения эндотелия образуется некоторое количество активных комплексов ТФ-ф.VIIа, которые активируют ф.Х до ф.Ха. ф.Ха на поверхности субэндотелия образует комплекс со своим кофактором ф.Vа. При этом превращение фактора V в активную форму осуществляется фактором Ха на поверхности клеток, несущих ТФ. Сформировавшийся протром-биназный комплекс приводит к образованию незначительного стартового количества тромбина.
Одновременно с ф.Ха комплекс ТФ-ф.VIIа активирует ф.IХ.
Большинство ТФ образует комплекс с неактивным ф.VII и не способно активировать ф.Х. Однако этот процесс имеет положительную обратную связь за счет следующих механизмов: 1) акти-
вации фактора VII в комплексе с ТФ образовавшимся фактором Ха; 2) активации ф.VII тромбином. Активированного на этом этапе тромбина недостаточно для образования фибринового сгустка, поскольку активация протромбина на мембранах субэндотелиальных клеток ограничивается целым рядом механизмов:
• Комплекс ТФ-ф.VIIа-ф.Ха быстро подавля
ется ингибитором пути тканевого фактора
(ИВП).
• ф.Ха, поступающий в плазму с поверхности
мембраны, также очень быстро ингибирует-
ся антитромбином III.
• Неактивированный фактор VII, который кон
курирует с фактором VIIa за места связыва
ния на ТФ, также вносит вклад в ограниче
ние процесса образования тромбина. Его
ингибиторный эффект наиболее значителен
при минимальной концентрации ТФ.
2-я фаза - усиление процесса свертывания крови. Образовавшееся в первой фазе небольшое количество тромбина не приводит к интенсивному образованию фибрина, однако это количество важно для активизации других компонентов системы гемостаза. Тромбин более устойчив к инактивации, чем фактор Ха. Он сохраняет свою активность в токе крови и играет ключевую роль в усилении процесса свертывания крови.
ф.IХ, активизированный на клетках субэндотелия в 1-й фазе процесса свертывания крови, так же как и тромбин, имеет относительно высокую устойчивость к ингибированию AT. Он преодолевает расстояние между мембраной клеток субэндотелия и мембраной активированного и адге-зированного тромбоцита. Там он фиксируется на тромбоцитарном ф.З и образует с ф.VIIIа теназ-ный комплекс.
Современная теория свертывания крови
Адгезированные к субэндотелию в области повреждения сосуда тромбоциты активируются за счет сигнала с рецепторов адгезии. Однако наиболее сильным стимулом является тромбин. Неактивированные и активированные тромбоциты имеют несколько рецепторов для тромбина: рецептор, активируемый протеазой (PAR1), глико-протеин Ib-V-IX (GPIb-V-IX) и, возможно, другие. Активированные тромбоциты экспонируют на своей поверхности тромбоцитарный фактор 3, или тромбоцитарный тромбопластин, и специфические рецепторы к различным факторам свертывания крови. Помимо изменений клеточной поверхности, тромбоциты секретируют содержимое пулов хранения, увеличивая локальную концентрацию прокоагулянтов.
GPIb-V-IX является рецептором не только тромбина, но и фактора Виллебранда, оба этих белка реагируют с различными частями рецептора, поэтому они могут связываться с одним рецептором одновременно. Тромбин, связанный с рецептором GPIb-V-IX, вычленяет ф.VIII из комплекса с фактором Виллебранда и активирует его. ф.VIIIa остается на тромбоцитарной поверхности, формируя теназный комплекс. Тромбин активирует фактор V, который выделяется в процессе секреции из альфа-гранул тромбоцитов; ф. Va также остается на поверхности активированных тромбоцитов, формируя протромбиназный комплекс.
Еще одним фактором свертывания, активируемым тромбином, образовавшимся под воздействием комплекса ТФ-ф.VIIа, является ф.ХIа, который связывается с поверхностью активированных тромбоцитов через цепь GPlba комплекса GPlb-V-IX.
Таким образом, небольшие количества тромбина, образовавшиеся в ходе первой фазы, обеспечивают в течение второй фазы свертывания крови распространение процесса активации свертывания крови на активированную тромбо-цитарную поверхность с одновременной трансформацией в активную форму факторов XI, IX, VIII и V.
3-я фаза - распространение процесса свертывания крови. Активированные тромбоциты имеют на своей поверхности рецепторы для факторов XI, ХIа, IX, IХа, X, VIII, VIIIa, V, Va, Xa, протромбина и тромбина. В 3-й фазе на их по-
верхности происходит формирование теназного и протромбиназного комплексов.
ф.VIIIa/IХа начинают ограниченный проте-олиз ф.Х до ф.Ха, последний с ф.Va образует протромбиназный комплекс и наращивает количество тромбина в зоне повреждения. Однако активированного на этом этапе тромбина еще недостаточно для образования полноценного фиб-ринового сгустка. Критическое количество активного фактора IХа, которое необходимо для остановки кровотечения, образуется под влиянием фактора ХIа. Показано, что ф.ХI связывается с GPIba тромбоцитов и активируется образовавшимся тромбином. Эта положительная обратная связь усиливает коагуляционный потенциал в 5000-10 000 раз.
Образование теназного комплекса, состоящего из энзима IХа и кофактора VIII, на поверхности тромбоцитов приводит к активации фактора X со скоростью, превышающей в 50-100 раз активацию фактора X под влиянием комплекса ТФ-ф.VIIа. Кроме того, факторы в этом комплексе относительно защищены от инактивации. Вследствие этого процесса образуется значительное количество тромбина, которого достаточно для формирования гемостатического тромба.
Одновременно с фибриногеном тромбин активирует фактор XIII (фибрин-стабилизирующий фактор). Параллельно тромбин активирует тром-бин-активируемый ингибитор фибринолиза (TAFI), который тормозит развитие фибринолиза и позволяет сформироваться плотному гемо-статическому тромбу, достаточному для надежной остановки кровотечения и развития репара-тивных реакций сосудистой стенки. Таким образом, в зоне повреждения возникают условия для формирования и стабилизации адекватного гемостатического тромба.
В нормальных условиях процесс развития тромба ограничивается несколькими механизмами:
• Тромбин в токе крови ингибируется анти
тромбином III.
• На интактных эндотелиальных клетках тром
бин связывается с тромбомодулином (ТМ), при
этом тромбин теряет свои коагуляционные
свойства и одновременно приобретает способ
ность активировать антикоагулянт протеин С.
• Эндотелиальные клетки усиливают инакти
вацию коагуляционных факторов антитром-
Современная теория свертывания крови
бином и TFPI, преимущественно за счет наличия на своей поверхности гепариноподоб-ных гликозаминогликанов.
• По мере удаления от места повреждения снижается прокоагулянтный стимул и возрастает антикоагулянтный. В зоне неповрежденного эндотелия он преобладает и ограничивает рост сгустка.
Параллельно с развитием реакций коагуляции адгезированные активированные тромбоциты выбрасывают содержимое своих гранул. Следствием этого является местное нарастание концентрации прокоагулянтов, в первую очередь факторов V, XIII, vWF, фибриногена. Тромбоцитар-ный фактор 4 (ТФ4) локально ингибирует гепарин и гепарансульфаты, усиливая процесс свертывания крови. Поступающие в кровь стимуляторы агрегации тромбоцитов активируют и рекрутируют из тока крови новые тромбоциты.
Полноценный гемостатический тромб формируется через 10-15 минут после начала полимеризации фибрина за счет стабилизации фибри-нового скелета ф.ХIII и ретракции.
Активация фибринолиза, видимо, происходит в первые секунды повреждения сосуда. Однако нарастание процесса фибринолиза в области формирования сгустка происходит медленнее, чем реакции свертывания, вследствие «работы» ингибиторов фибринолиза. Это необходимо для эффективной остановки кровотечения и репарации поврежденных тканей. Однако на периферии, в области неповрежденного эндотелия, фибрино-лиз значительно более выражен и ограничивает распространение сгустка. Постепенно, по мере репарации сосудистой стенки, интенсивность воздействия прокоагулянтных стимулов снижается и нарастает активность фибринолитических реакций, что приводит в конечном итоге к лизису сгустка и восстановлению кровотока в сосуде.
В процессе развития ответной реакции на повреждение сосудистой стенки эндотелий и тромбоциты выбрасывают не только вещества, обладающие гемостатической активностью, но и стимуляторы репарации, хемотаксические вещества для фагоцитов, иммуномодуляторы, что обеспечивает комплексный ответ на повреждение.
Особенности физиологии и исследования гемостаза у плодов и детей
Date: 2015-05-19; view: 647; Нарушение авторских прав