
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Закономерности в атомных спектрах
|
|
Содержание
Введение…………………………………………………………..………4
1.Атом водорода в теории Бора.
Закономерности в атомных спектрах…………………………………...5
2.Волновые свойства микрочастиц.
Соотношение неопределенностей……………………………………..16
3.Элементы ядерной физики……………………….…………………..23
4.Элементы квантовой механики…………………..………………….35
Введение
В сборнике представлены тестовые задания закрытого типа и на соответствие по разделам «Элементы квантовой теории», «Основы атомной и ядерной физики», предназначенные для аудиторной и внеаудиторной самостоятельной работы студентов.
Тестовые задания сгруппированы по темам «Атом водорода в теории Бора», «Волновые свойства микрочастиц», «Элементы квантовой механики», «Элементы ядерной физики».
Содержание тестовых заданий направлено на формирование у студентов знаний физических явлений, законов, формул, единиц измерения физических величин, умения применять законы и формулы для решения качественных и расчетных задач, графически представлять физические явления и законы, анализировать их.
В тестовых заданиях закрытой формы из 3–5 приведенных ответов следует выбрать правильный. В некоторых заданиях правильных ответов может быть два и более. В заданиях на соответствие необходимо установить соответствие элементов одного множества элементам другого. Тестовые задания такой формы сопровождаются инструкцией «Установить соответствие».
Самостоятельная работа студентов с тестовыми заданиями поможет при подготовке к практическим и лабораторным занятиям, а также будет способствовать более глубокому изучению разделов курса общей физики «Элементы квантовой теории», «Основы атомной и ядерной физики».
АТОМ ВОДОРОДА В ТЕОРИИ БОРА
ЗАКОНОМЕРНОСТИ В АТОМНЫХ СПЕКТРАХ
1. Полная энергия электрона в атоме водорода на n –ом энергетическом уровне, равна:
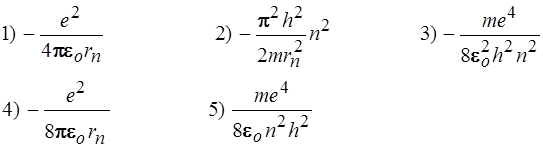
2. Скорость движения электрона в атоме водорода на орбите радиуса r можно оценить как величину:
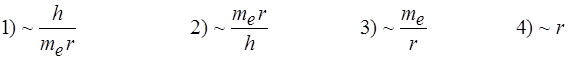
5) Нельзя оценить
3. Радиус n – й орбиты электрона в атоме водорода по Бору, равен:

4. Кинетическая Е K, потенциальная Е П и полная Е энергии атома водорода связаны следующим образом:
1) Е = Е П = 1/2 Е K 2) Е = – Е П = 1/2 Е K 3) Е = 1/2 Е П = – Е K
4) Е = – 1/2 Е П = Е K 5) Е = 2 Е П = 2 Е K
5. Кинетическая Е K и потенциальная Е П энергии электрона в атоме водорода при переходе от нижних уровней к верхним изменяется следующим образом:
1) Е К – возрастает, Е П – возрастает;
2) Е К – возрастает, Е П – убывает;
3) Е К – убывает, Е П – убывает;
4) Е К – убывает, Е П – возрастает;
5) Е К и Е П – не изменяются.
6. При переходе электрона атома водорода с 5–й на 1–ю стационарную орбиту его энергия:
1) Увеличивается в 25 раз;
2) Уменьшается в 25 раз;
3) Увеличивается в 5 раз;
4) Уменьшается в 5 раз;
5) Не изменяется.
7. Полная энергия электрона в атоме водорода для основного состояния Е = –13,6 эВ. Кинетическая энергия электрона для этого состояния равна (эВ):
1) 13,6 2) 10,2 3) 6,8 4) – 6,8 5) – 13,6
8. Полная Е и кинетическая Е K энергии электрона в атоме водорода в 1 – м возбужденном состоянии, равны (эВ):
1) Е =10,2 Е К=5,1 2) Е =10,2 Е К= –10,2 3) Е = –10,2 Е К=10,2
4) Е = –3,4 Е К =3,4 5) Е = –3,4 Е К = 10,2
9. Скорость электрона в одноэлектронном атоме:
1. Зависит от массы и заряда ядра;
2. Зависит от заряда ядра и не зависит от номера электронной орбиты;
3. Изменяется от нуля до бесконечности;
4. Зависит только от массы и номера электронной орбиты;
5. Зависит только от заряда ядра и номера электронной орбиты.
10. Скорость электрона на 3 – й орбите атома водорода равна (м/с):
1) 2,2·10–6 2) 1,1·106 3) 7,3·105 4) 6,6·106 5) 0,5·105
11. Скорость электрона на 3 – й орбите в дважды ионизированном атоме лития равна (м/с):
1) 2,3·10–6 2) 3,3·105 3) 1,1·105 4) 5,6·104 5) 0,5·106
12. Радиусы 2 – й и 3 – й орбит электрона атома водорода по Бору отличаются:
1) 2/3 раза 2) (2/3) 2 раза 3) 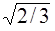 раза 4) Одинаковы
раза 4) Одинаковы
5) Данных не достаточно
13. Радиусы 1 – й и 3 – й орбит электрона атома водорода по Бору отличаются:
1) 3 раза 2) 6 раз 3) 9 раз 4) 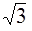 раза 5) Одинаковы
раза 5) Одинаковы
14. Минимальная энергия, необходимая для возбуждения полного спектра атомов водорода, равна (эВ):
1) 1,87 2) 3,4 3) 12,1 4) 13,6 5) 16,8
15.Минимальная энергия, необходимая для возбуждения полного спектра дважды ионизированных атомов лития, равна (эВ):
1) 13,6 2) 27,2 3) 40,8 4) 54,4 5) 122,4
16. Если энергия ионизации атома водорода 13,6 эВ, то энергия фотона, соответствующего 2 –й линии серии Бальмера, равна (эВ):
1) 2,6 2) 3,4 3) 5,6 4) 10,2 5) 1,9
17. Если энергия ионизации атома водорода Е i, то первый потенциал возбуждения атома равен (е – заряд электрона):
1) Е i / е 2) Е i /2 е 3) (3/4) Е i / е 4) (2/3) Е i / е 5) (1/4) Е i / е
18. Первый потенциал возбуждения атома водорода равен (В):
1) 3,4 2) 6,8 3) 10,2 4) 13,6 5) 17,3
19. Первый потенциал возбуждения дважды ионизированных атомов лития равен (В):
1) 12,4 2) 92 3) 54,4 4) 27,2 5) 13,6
20. Энергия фотона, испускаемого при переходе электрона в атоме водорода с 3 – го на 2 – й энергетический уровень, равна (эВ):
1) 13,6 2) 12,4 3) 10,2 4) 1,89 5) 0,63
21. Если энергия ионизации атома водорода Е i = 13,6 эВ, то 1 – й потенциал возбуждения этого атома (В):
1) 13,6 2) 10,2 3) –13,6 4) 3,4 5) 12,1
22. Для ионизации атома кислорода необходима энергия»14 эВ. Частота излучения, которая вызывает ионизацию, равна (Гц):
1) 3,4·1012 2) 0,3·1015 3) 3,4·1015 4) 6,8·1015 5) 6,6·1016
23. В соответствии с законами классической электродинамики электрон излучал бы наибольшее количество энергии, двигаясь по орбите с номером:
1) 1 2) 2 3) 3 4) ¥
5) Во всех случаях атом излучал бы одинаково
24. 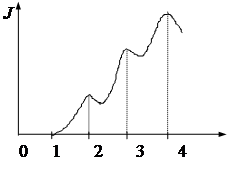 Второй потенциал возбуждения атома в опыте Франка и Герца соответствует точке рис. 1:
Второй потенциал возбуждения атома в опыте Франка и Герца соответствует точке рис. 1:
1) 1
2) 2
3) 3
4) (4 – 3)
5) По этому графику 2–й потенциал
возбуждения не определяется Рис. 1
25. Появление пиков на вольт – амперной характеристике в опытах Франка и Герца объясняется:
а) колебаниями напряжения на аноде
б) наличием упругих столкновений электронов с атомами
в) наличием неупругих столкновений электронов с атомами
г) дискретностью энергетических уровней атомов
1) Только а 2) Только б, г 3) Только в, г
4) Только б, в 5) Только в
26. Излучение с частотой n =2× R×с (R –постоянная Ридберга, с – скорость света) атом водорода:
1) Поглощает, переходя на 2–й энергетический уровень
2) Поглощает, переходя на уровень n = ¥
3) Поглощает с любой частотой n = Rс, 2 Rс, 3 Rс,...
4) Не поглощает, так как энергия кванта излучения превышает энергию ионизации атома водорода
5) Не поглощает, так как энергия кванта излучения меньше энергии 2–го энергетического уровня атома водорода
27. При облучении атома водорода длиной волны l0 электрон перешел с m – й на n – юорбиту (m < n), а при возвращении в исходное состояние электрон перешел сначала с n – й орбиты на k – ю, испустив квант света с длиной волны l1, а затем на m – ю (n > k > m) стационарную орбиту, излучив свет с длиной волны l2. Тогда:
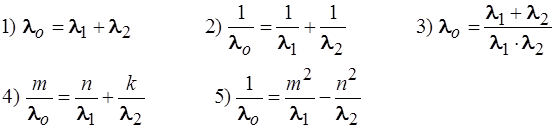
28. Количество спектральных линий, которое будет испускать атомарный водород, находящийся в основном состоянии, равно:
1) n 2) n 2 3) 0 4) n ·(n –1) 5) 2 n
29. Количество спектральных линий, которое будет испускать атомарный водород, возбужденный на n – й энергетический уровень, равно:
1) n 2) n 2 3) n · (n –1) 4) (1/2) n . (n –1) 5) 2 n 2
30. Количество спектральных линий, которое будет испускать атомарный водород, возбужденный на 4 – й энергетический уровень, равно:
1) 3 2) 4 3) 5 4) 6 5) 7
31.Чтобы в спектре атома водорода появилась только одна линия серии Бальмера, ему надо сообщить энергию E (эВ):
1) 12,1 < E < 12,7 2) 12,7 < E < 13,6 3) 1,5 < E < 3,4
4) 8 < E < 11,5 5) 1,9 < E < 3,4
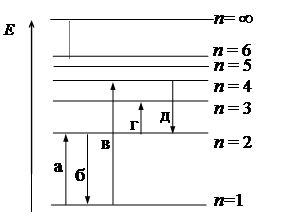 32.Поглощению наибольшей длины волны ультрафиолетовой серии, показанной на рис. 2, соответствует переход:
32.Поглощению наибольшей длины волны ультрафиолетовой серии, показанной на рис. 2, соответствует переход:
1) а
2) б
3) в
4) г
5) д
Рис. 2
33.Длина волны света, излучаемого возбужденным атомом водорода при переходе электрона на 2 – й энергетический уровень, если радиус орбиты электрона изменился в 9 раз, равна (м):
1) 5·10–9 2) 7,3·10–9 3) 4,1·10–7 4) 6,510–7 5) 7,3·10–7
34. Водородный спектр, длины волн линий которого в 4 раза короче, чем у атомарного водорода принадлежит элементу:
1) Н2 2) Не 3) Не + 4) Li + + 5) Be + + +
35. Фотон с энергией 13,6 эВ выбивает электрон из покоящегося атома водорода, находящегося в основном состоянии. Кинетическая энергия электрона вдали от ядра равна (эВ):
1) –13,6 2) 10,2 3) 3,4 4) 0 5) 13,6
36. При излучении атомом водорода с длиной волны l=4,86·10–7м, кинетическая энергия электрона в атоме изменится на (эВ):
1) 10,2 2) 5,6 3) 2,56 4) 1,89
5) Кинетическая энергия не изменится
37. Фотон с энергией 15 эВ выбивает электрон из покоящегося атома водорода, находящегося в основном состоянии. Скорость электрона вдали от ядра равна (м/с):
1) 7·105 2) 7·106 3) 9·107 4) 0,49·105 5) 0,49·104
38. Скорость, которую приобретет первоначально покоившийся атом водорода после испускания фотона, соответствующего красной границе серии Лаймана, равна (м/с):
1) 3,2·103 2) 8,2·10–2 3) 3,3 4) 4,5·102 5) 0,2
 39.Излучению наибольшей длины волны в видимой серии соответствует переход, рис. 3:
39.Излучению наибольшей длины волны в видимой серии соответствует переход, рис. 3:
1) а
2) б
3) в
4) г
5) д
Рис.3
40. Длина волны границы серии Бальмера 364 нм, длина волны границы серии Пашена равна (нм):
1) 654 2) 820 3) 892 4) ¥ 5) 1454
41.

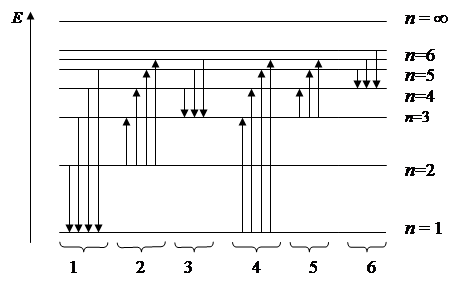 ИК – поглощению атома водорода соответствует серия линий рис.4:
ИК – поглощению атома водорода соответствует серия линий рис.4:
1) 1 и 4
2) 5 и 6
3) 6
4) 5
5) 5 и 3
Рис. 4
42. На схеме энергетических уровней атома водорода (рис.5) излучению наибольшей длины волны в ультрафиолетовой серии Лаймана соответствует переход:
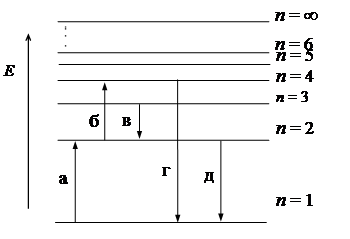 |
1) а
2) б
3) в
4) г
5) д
Рис. 5
43. На рис. 6 представлена одна из спектральных серий атома водорода. Длинноволновой границей этой серии является:
1) l i
2) l K
3) ¥
 4) среди ответов 1–3 нет верного
4) среди ответов 1–3 нет верного
l i l K
Рис. 6
44.Вращению электрона на 1–й орбите атома водорода соответствует эквивалентный ток, равный:
1) 1,06 mA 2) 1,06 m 3) 6,58 mA 4) 10,6 mA 5) 6,58 mA
45.Напряженность электрического поля, в котором находится электрон в невозбужденном атоме водорода, равна (В/м):
1) 2,7·107 2) 2,6·1011 3) 5,1·1011 4) 1,2·1010 5) 2,6·109
46. Напряженность электрического поля на 2–й орбите однозарядного иона гелия равна (В/м):
1) 27,2·106 2) 2,6·1011 3) 5,1·1011 4) 1,2·1011 5) 2,6·109
47. Установить соответствие:
| Энергия электрона в атоме | Формула | |
| 1) Кинетическая энергия 2) Потенциальная энергия 3) Полная энергия | 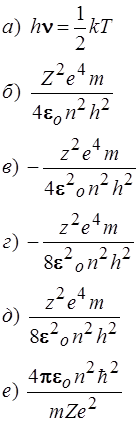
|
48. Установить соответствие:
| Постулаты Бора | Формулировка | |
| 1) Первый постулат (постулат стационарных состояний) 2) Второй постулат (правило квантования орбит) 3) Третий постулат (правило частот) | а) Энергия электрона в атоме принимает непрерывный ряд значений
б) Существуют некоторые стационарные состояния атома, находясь в которых он не излучает и не поглощает энергии
в) В стационарном состоянии атома электрон, двигаясь по круговой орбите, имеет квантованные значения момента импульса 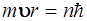 г) Электрон в атоме не может иметь одновременно вполне точные значения координаты Х и импульса РХ
д) При переходе атома из одного состояния в другое испускается или поглощается квант энергии
E=Eп–Em
г) Электрон в атоме не может иметь одновременно вполне точные значения координаты Х и импульса РХ
д) При переходе атома из одного состояния в другое испускается или поглощается квант энергии
E=Eп–Em
|
49. Установить соответствие:
| Красная граница серии атома водорода | Частота (Гц) | |
| 1) Лаймана 2) Бальмера 3) Пашена | а) 1,6 . 1014 б) 2,45 . 1015 в) 3 . 1016 г) 1,2 . 1017 д) 0,46 . 1015 |
50. Установить соответствие:
| Физическая величина | Формула | |
| 1) Радиус 1–й орбиты электрона в атоме водорода 2) Длина волны Де–Бройля частицы в релятивистском случае 3) Длина волны Де–Бройля частицы в классическом приближении | 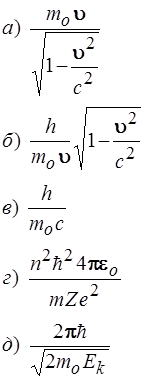
|
51. Установить соответствие:
| Физическая величина | Формула | |
| 1) Энергия ионизации водородоподобного атома 2) Постоянная Ридберга 3) Момент импульса электрона на стационарных орбитах | 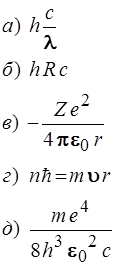
|
52. Частица массы m движется в центрально – симметричном силовом поле F = – kr. Полагая, что момент импульса частицы может иметь лишь значения, кратные 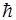 (как в теории атома Бора), возможный радиус круговой орбиты частицы рассчитывают по формуле:
(как в теории атома Бора), возможный радиус круговой орбиты частицы рассчитывают по формуле:
1)  2)
2)  3)
3) 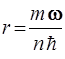
4) 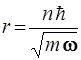 5)
5) 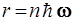
Date: 2015-05-18; view: 3277; Нарушение авторских прав