
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Следствия второго начала термостатики
|
|
Следствия второго начала термостатики широко применяются в термодинамических расчетах и формулируются на основе анализа его математического выражения (162), (163).
Следствие I. Совместное выражение первого начала термодинамики и второго начала термостатики позволяет получить дифференциальное уравнение термодинамики, которое связывает между собой все термодинамические свойства веществ
T ds= cv dT + 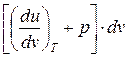 = cp dT +
= cp dT + 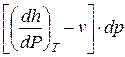 . (164)
. (164)
Следствие II. Координаты Т - S являются универсальными координатами термодинамического теплообмена.
Рассмотрим процесс 1-2 в координатах Т-S и выделим на нем элементарный участок с температурой Т и изменением энтропии dS (рис. 14).
|
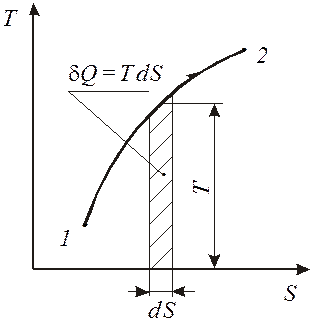 |
Исходя из математического выражения второго начала термостатики площадь под кривой элементарного участка процесса равна подводимому (отводимому) количеству теплоты
d Q = T×dS. (165)
При этом полное количество теплоты, подведенной или отведенной от системы в процессе 1-2, определяется следующим образом:
Q1,2 = 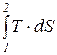 . (166)
. (166)
Если из-под знака интеграла в соотношении (166) вынести среднюю температуру конечного процесса Tm, то количество теплоты в процессе может быть определено по соотношению
Q1,2 = Tm × (S2 - S1). (167)
Как видно из выражения (166) и рис. 15, знак теплообмена определяется знаком изменения энтропии. Процессы, протекающие с увеличением энтропии, сопровождаются подводом теплоты. Процессы, протекающие с уменьшением энтропии - отводом теплоты. Независимо от природы рабочего тела площадь под кривой процесса в координатах Т-S равна количеству подведенной или отведенной теплоты.
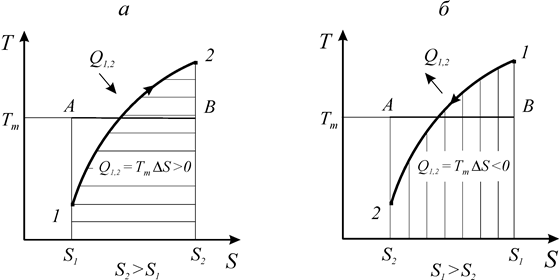
Рис. 15. Теплообмен в термодинамических процессах
Следствие III. Адиабатный процесс является процессом изоэнтропийным.
Так как в адиабатном процессе теплообмен отсутствует (d Q = 0), то, согласно второму началу термостатики (162), в таком процессе изменение энтропии dS = 0 (S = idem). Согласно этому следствию, показатель адиабатного процесса (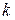 ) равен показателю изоэнтропийного процесса (
) равен показателю изоэнтропийного процесса (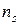 )
)
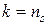 . (168)
. (168)
Следствие IV. Коэффициент полезного действия и холодильный коэффициент термодинамических циклов тепловых машин не зависят от вида цикла и природы рабочего тела, а определяются лишь средними абсолютными температурами рабочего тела в процессах подвода и отвода теплоты.
Рассмотрим термодинамические циклы в координатах Т-S: прямой цикл (цикл теплового двигателя) 1-А-2-В-1 (а) и обратный цикл (цикл холодильной машины) 1-А-2-B-1 (б) (рис. 16).
В процессе 1-А- 2 теплота подводится к рабочему телу. Количество подводимой теплоты соответствует на диаграмме горизонтально заштрихованной площади. Вертикально заштрихованная площадь соответствует количеству отведенной теплоты от рабочего тела в процессе 2-В-1.
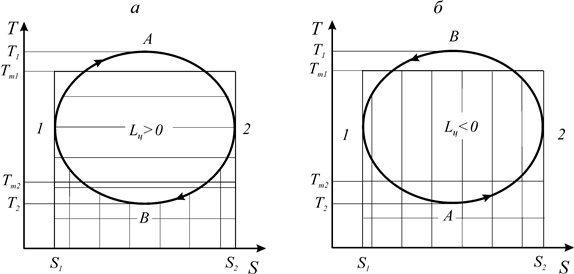
Рис. 16. Прямой и обратный циклы в координатах Т-S
Средние температуры рабочего тела в процессах подвода и отвода
теплоты в цикле теплового двигателя обозначим Тm1 и Тm2
соответственно (рис. 16а). Согласно выражения (167), количества подведенной и отведенной теплоты определяется по следующим соотношениям:
ú Q1 ç = 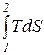 = Tm1 × (S2 - S1 ) = Tm1 ×úD S1,2 ç; (169)
= Tm1 × (S2 - S1 ) = Tm1 ×úD S1,2 ç; (169)
ú Q2 ç = 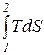 = Tm2 ×× (S2 - S1 ) = Tm2 ×úD S1,2 ç, (170)
= Tm2 ×× (S2 - S1 ) = Tm2 ×úD S1,2 ç, (170)
а коэффициент полезного действия любого термодинамического цикла теплового двигателя может быть найден из выражения
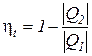 =
= 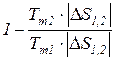 =1 -
=1 - 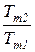 . (171)
. (171)
В результате аналогичных рассуждений получаем выражение для определения холодильного коэффициента термодинамического цикла холодильной машины (рис. 16б)
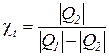 =
= 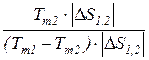 =
=  . (172)
. (172)
Полученные выражения (171), (172) свидетельствуют о том, что КПД и холодильный коэффициент термодинамических циклов тепловых машин определяются только средними абсолютными температурами рабочего тела в процессах подвода и отвода теплоты.
Из уравнений (171), (172) следует также, что для любого термо-динамического цикла тепловых машин выполняется следующее соотношение:
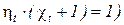 . (173)
. (173)
Следствие V. Коэффициент полезного действия и холодильный коэффициент цикла Карно всегда выше этих коэффициентов эффективности для любых других термодинамических циклов тепловых машин, осуществляемых в одинаковом диапазоне предельных температур рабочего тела (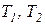 ).
).
Это следствие вытекает из анализа соотношений по определению КПД цикла Карно (153) и любого термодинамического цикла (171) теплового двигателя. Вследствие того, что Т1 >Тm1 и Т2 < Тm2 (рис. 16а),
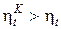 . (174)
. (174)
Аналогичный вывод можно сделать и при сравнении холодильных коэффициентов обратных циклов
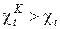 . (175)
. (175)
Рассматриваемое следствие утверждает, что цикл Карно является эталонным циклом, по сравнению с которым можно определить термодинамическое совершенство любого цикла, осуществляемого в заданном интервале предельных значений температур рабочего тела.
Следствие VI. Изменение энтропии системы равно сумме изменений энтропии всех тел, входящих в систему (теорема аддитивности энтропии).
Количество теплоты, полученное в элементарном процессе системой, состоящей из 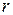 тел, можно определить из соотношения
тел, можно определить из соотношения
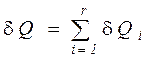 , (176)
, (176)
что и подтверждает справедливость сформулированного следствия
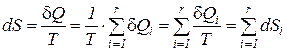 . (177)
. (177)
Date: 2015-05-09; view: 768; Нарушение авторских прав