
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Изотермы Эндрюса
|
|
Английский физик Эндрюс во второй половине прошлого века произвел ряд исследований свойств паров и построил экспериментальные изотермы. В толстостенный цилиндр под поршнем вводились пары углекислого CO2, давление измерялось при помощи манометра.
При изотермическом уменьшении объема давление возрастало и на графике, соответствующем данному процессу (рис. 3.2), получался участок изотермы 1-2, приближающийся к гиперболе. Таким образом опыты Эндрюса подтвердили, что ненасыщающие пары подчиняются закону Бойля - Мариотта. Точка 2 соответствует объему V2 и показывает состояние паров CO2, при котором они насыщают пространство. При дальнейшем уменьшении объема в цилиндре часть паров переходит в жидкость, а давление оставшихся над жидкостью паров сохраняется при данной температуре неизменным. На графике получается участок 2-3, соответствующий одновременному существованию вещества в двух фазах (в двух агрегатных состояниях) - жидкой и газообразной.
Точка 3 соответствует объему V3 и показывает такое состояние, когда пар полностью обращается в жидкость. Дальнейшее увеличение давления вызывает сжатие жидкости, а так как жидкости крайне слабо сжимаются, участок изотермы 3-4 представляет почти вертикальную линию, лишь незначительно приближающуюся к оси Y.
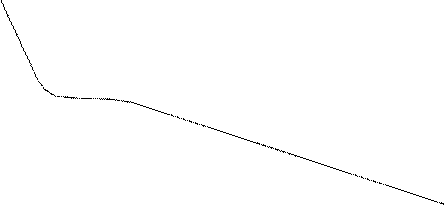
На рис. 3.3. показан ряд таких изотерм, соответствующих одной и той же массе CO2, но построенных для разных температур. Чем выше температура, тем участок 2-3 короче, т.е. разность в объемах насыщающего пара (V2) и полученной из него при полной конденсации жидкости (V3) становится меньше.
При некоторой определенной температуре площадка 2-3 исчезает, на графике возникает точка перегиба K, которая носит название критической точки. Температура, при которой она получается, называется критической температурой (Tк), давление, соответствующее точке K - критическим давлением (pк), а объем, занимаемый при этом молем газа - критическим объемом (Vк). При критической температуре ненасыщающий пар переходит в жидкое состояние, как бы минуя стадию насыщения. Для CO2 критическая температура равна 31˚C, критическое давление около 73 атм.

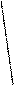
 p 4
p 4

 2
2
 |
0 V2 V
Рис. 3.2. Изотерма паров СО2, полученная в экспериментах Эндрюса
При температурах выше критической вещество может существовать только в газообразном состоянии и ни при каком давлении не обращается в жидкость.
Понятие о критической температуре впервые было введено в науку Д.И. Менделеевым 1861 г. Он отметил, что при повышении температуры силы взаимодействия между молекулами жидкости слабеют, коэффициент поверхностного натяжения жидкости уменьшается, а при некоторой температуре обращается в нуль. Эту температуру Менделеев назвал температурой абсолютного кипения.



 р
р

 рк К
рк К
 Жидкость+пар
Жидкость+пар
 |
0 Vk V
 Рис. 3.3 Изотермы Эндрюса, соответствующие разным температурам
Рис. 3.3 Изотермы Эндрюса, соответствующие разным температурам
В табл. 3.2 приведены данные о критических температурах, давлениях и объемах для некоторых веществ.
Т а б л и ц а 3.2
Критические параметры некоторых веществ
| Вещество | Tk, ˚С | Pk, атм | Vk, см3/моль |
| Вода Хлор Углекислый газ Кислород Азот Водород Гелий | -118 -147 -240 -268 | 33,5 12,80 2,26 | 57,6 124,0 96,0 74,3 90,0 65,0 58,0 |
Из этой таблицы, в частности, следует, что при температурах, больших 374˚C, вода не может существовать в жидком состоянии, какое бы давление мы на нее ни оказывали. Для получения сжиженных газов, их следует предварительно охлаждать до температуры ниже критической и установка должна создавать давление порядка pк.
Date: 2015-05-09; view: 1713; Нарушение авторских прав