
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Правило фаз Гиббса
|
|
Это один из самых общих законов физической химии. Он основывается на втором законе термодинамики и относится к системам, находящимся в равновесии.
Если на систему из внешних термодинамических факторов влияют только давление (Р) и температура (Т), то в равновесной многофазовой системе число степеней свободы равно числу независимых компонентов системы плюс два, минус число фаз.
С = КН + 2 – Ф (1)
где С – термодинамическая степень свободы,
КН – число независимых компонентов,
Ф – число фаз.
Определение КН
Вещество, которое может быть выделено из системы и существовать вне ее, называется компонентом системы (составной частью системы).
Наименьшее число компонентов (составных частей) системы, достаточных для образования всех фаз системы называемых числом независимых компонентов (КН). Число независимых компонентов и общее число компонентов КТ (т.е. число составных частей системы) различаются в том случае, если между компонентами системы происходит химическое взаимодействие.
Свойства системы определяются числом компонентов. Число независимых компонентов равняется общему числу компонентов минус число уравнений, связывающих концентрации этих веществ в равновесной системе.
Для пояснения рассмотрим несколько примеров подсчетом числа компонентов в одно- и многофазовых системах.
Пример 1. Однофазная простейшая система смесь газов, составленная на пример из гелия (Не), водорода (Н2), аргона (Ar). Между данными компонентами химическая реакция невозможна. Система осуществима при любых концентрациях каждого из составляющих компонентов. Следовательно, КН = КТ = 3 (общему числу составляющих веществ).
Пример 2. Однофазная система состоит из газообразных веществ, реагирующих друг с другом
H2 (г) + J2(г) = 2 НJ(г)
то при равновесии концентрации составляющих веществ подчиняются уравнению:
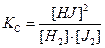
где КС – константа равновесия, имеющая определенное значение при заданной температуре.
В этом случае состав равновесной системы определяется концентрацией только двух произвольно взятых веществ, т.к. концентрация третьего вещества будет иметь строго определенное значение. Иными словами: в системе только два независимых составляющих компонента, т.е. КН = KТ -1 = 3 – 1 = 2. Если же три компонента связаны двумя уравнениями, например:
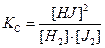 и
и 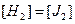
то число независимых компонентов уменьшается на два.
КН = КТ – 2 = 3 - 2 = 1.
Это значит что при наличии двух уравнений в данной системе возможен лишь один независимый компонент (составляющее вещество), т.е. система обладает свойствами однокомпонентной системы. Действительно, она может быть построена из одного HJ, который распадаясь будет давать одинаковые концентрации 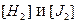
Пример 3. Двухфазная система.
а) NH4CI(Г) «HCI(Г) + NH3(Г)
При равновесии концентрации веществ, образующих газовую фазу, подчиняются уравнению KC = [NH3] • [HCI] и потому число компонентов
КН = 3 – 1 = 2,
т.е. для построения заданной двухфазной системы достаточно двух веществ, например NH4CI и HCI и т.д.
Если ввести второе условие [NH3] = [HCI], то число КН. уменьшится до 3 – 2 = 1. Действительно, система, удовлетворяющая обоим уравнениям, получается из одного твердого NH4CI, обе фазы могут быть составлены из одного твердого NH4CI.
б) СаСО3(Т) = СаО(Т) + СО2(Г)
При равновесии имеет место уравнение КС = [СО2]. Поэтому
КН = 3 – 1 =2,
т.е. система может быть построена например из СаО и СО2 или СаСО3 и СаО.
Но данная система не может обладать свойствами однокомпонентной системы, если количество молей СаО окажется равным количеству молей СО2.
Дело в том, что равенство количеств двух составляющих веществ в гетерогенной системе еще не означает равенства их концентраций в какой-либо из фаз, и следовательно, нет оснований для составления второго уравнения, характеризующего состав газообразной фазы.
Следовательно, КН. = КТ – х, где х – число равновесий в химических реакциях.
Date: 2015-05-09; view: 1422; Нарушение авторских прав