
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Термодинамические процессы
|
|
РЕАЛЬНЫХ ГАЗОВ
Пары. Основные понятия и определения
Во всех областях промышленного производства получили большое применение пары различных веществ: воды, аммиака, углекислоты и др. Наибольшее распространение получил водяной пар, являющийся рабочим телом в паровых турбинах, паровых машинах, в атомных установках, теплоносителем в различных теплообменниках и т. п.
Процесс превращения вещества из жидкого в газообразное состояние называется парообразованием, которое происходит всегда при любой температуре со свободной поверхности тела. Такой процесс парообразования называется испарением.
Испарение, кипение, парообразование - это один процесс, связанный с переходом тела из жидкого в газообразное состояние.
Испарение - парообразование со свободной поверхности тела, а кипение - парообразование по всему объему тела.
Парообразование связано с изменением внутренней кинетической энергии молекул жидкости. С увеличением температуры увеличивается кинетическая энергия и увеличивается интенсивность испарения и парообразования.
Обратный процесс перехода газообразного вещества в жидкое состояние называется конденсацией. Жидкость, образующаяся в процессе конденсации называется конденсатом. Процесс перехода твердого вещества непосредственно в пар называется сублимацией. Обратный процесс перехода газообразного вещества в твердое состояние называется десублимацией.
Если парообразование жидкости происходит в неограниченном объеме, то вся она может превратиться в пар. При парообразовании в замкнутом объеме, вылетающие из жидкости молекулы, заполняют свободное пространство над жидкостью. При этом часть, движущаяся над жидкостью возвращается обратно в жидкость. В некоторый момент между парообразованием и обратным переходом молекул в жидкость наступает равенство, при котором число молекул, вылетающих из жидкости становится равным числу молекул, возвращающихся в жидкость. В этот момент в пространстве над жидкостью будет находиться максимальное число молекул. Пар в этом состоянии имеет максимальную плотность при данной температуре и называется насыщенным.
Насыщенный пар находится в термическом равновесии с жидкостью. При изменении температуры термическое равновесие нарушается, при этом изменяются плотность и давление насыщенного пара.
8.2. Процесс парообразования, pv - диаграмма
Рассмотрим процесс парообразования при постоянном давлении в pv - координатах, рис. 8.1. Некоторому давлению 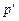 = const соответствует удельный объем v o не кипящей воды при температуре 0°С. Если нагревать воду при этом давлении, то ее температура увеличится до t н °С (температура насыщения), которая соответствует состоянию кипения воды (точка
= const соответствует удельный объем v o не кипящей воды при температуре 0°С. Если нагревать воду при этом давлении, то ее температура увеличится до t н °С (температура насыщения), которая соответствует состоянию кипения воды (точка 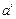 ). Удельный объем при этом увеличится до
). Удельный объем при этом увеличится до 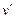 . Дальнейший подвод теплоты приводит к испарению воды. Так как объем пара во много раз больше объема кипящей воды, то точка
. Дальнейший подвод теплоты приводит к испарению воды. Так как объем пара во много раз больше объема кипящей воды, то точка 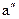 , соответствующая состоянию, когда вся вода превратится в пар, переместится по линии
, соответствующая состоянию, когда вся вода превратится в пар, переместится по линии 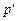 = const вправо. Пар в точке
= const вправо. Пар в точке 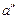 называется сухим насыщенным. Его удельный объем равен
называется сухим насыщенным. Его удельный объем равен 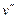 . Область от
. Область от 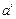 до
до 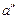 относится к влажному пару, представляющему собой двухфазную систему (пар - кипящая вода).
относится к влажному пару, представляющему собой двухфазную систему (пар - кипящая вода).
Относительное содержание массы сухого пара в двухфазной системе влажного пара называется сухостью пара
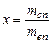 .
.
Сухость пара изменяется от 0 до 1. В состоянии v o (точка а о) сухость пара x = 0; в состоянии при 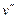 (точка
(точка 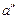 ) сухость пара x = 1.
) сухость пара x = 1.
Основное свойство насыщенного пара заключается в том, что температура при p = const остается постоянной (T = const) во всей области насыщенного пара от x = 0 до x = 1. Отсюда следует, что в области насыщенного пара изобара совпадает с изотермой, т. е. каждому давлению соответствует определенная температура насыщения. В специальных таблицах, составленных для сухого насыщенного пара, приводятся установленные опытным путем значения температуры (°С) в зависимости от давлений (МПа).
р...... 0,1013 1,555 8,592 22,087
t н..... 100 200 300 374
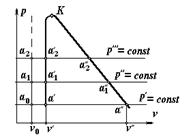
Рис. 8.1. pv -диаграмма парообразования
Температура насыщения увеличивается с повышением давления. При дальнейшем подводе теплоты к сухому насыщенному пару при постоянном давлении происходит увеличение температуры и удельного объема. В таком состоянии пар называется перегретым. Т.о. перегретым называется пар, у которого при данном давлении температура выше температуры насыщения. Удельный объем перегретого пара обозначается v, а температура t.
В области перегретого пара изобара не совпадает с изотермой. Если воду нагревать при других более высоких давлениях 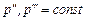 , то точки а 1, а 2, а 3,... состояния воды будут располагаться на вертикальной изохоре, вследствие практической несжимаемости жидкости. Точки кипения воды
, то точки а 1, а 2, а 3,... состояния воды будут располагаться на вертикальной изохоре, вследствие практической несжимаемости жидкости. Точки кипения воды 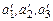 будут располагаться также на практически вертикальной изохоре, но с небольшим сдвигом вправо, вследствие объемного расширения жидкости с ростом температуры насыщения. Точки
будут располагаться также на практически вертикальной изохоре, но с небольшим сдвигом вправо, вследствие объемного расширения жидкости с ростом температуры насыщения. Точки 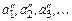 из-за уменьшения удельного объема жидкости с повышением давления переместятся влево.
из-за уменьшения удельного объема жидкости с повышением давления переместятся влево.
Соединив между собой точки а одинакового состояния, получим три линии. Первая, проходящая через точки а о - а 2 представляет собой состояние не кипящей воды при температуре t = 0°С, вторая называется нижней пограничной кривой при x = 0. Она отделяет область жидкой фазы от области насыщенного пара. Третья линия выражает собой состояния перегретого насыщенного пара. Эта линия называется верхней пограничной кривой (х = 1), она отделяет область насыщенного пара от области перегретого пара.
Точка К является критической точкой. Ей соответствует критическое давление водяного пара 22,129 МПа и критическая температура T = 273,16 K (373,16°C) и критический объем v к = 0,00326 м3/кг.
8.3. Ts - диаграмма водяного пара
На Ts -диаграмме, рис. 8.2. линия a-b-c-d представляет процесс парообразования при некотором давлении p = const.
На графике a - b процесс изобарного нагревания воды до температуры насыщения. Состояние воды при T o = 273,16 K и энтропии s o соответствует точке а. В точке b состояние кипящей воде при некотором давлении p = const соответствует температура T н и энтропия 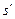 . Приращение энтропий вдоль изобары a - b:
. Приращение энтропий вдоль изобары a - b:
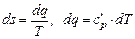 , тогда
, тогда 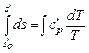 .
.
Принимая 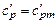 , находим:
, находим:
 ,
, 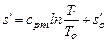 .
.
Горизонтальная прямая b - c представляет собой процесс испарения при p = const, протекающий при постоянной температуре насыщения Т н. Т. е. соответствует состоянию сухого насыщенного пара и определяется от состояния кипящей жидкости (х = 0) до состояния полного насыщения (х = 1)
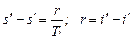 ,
,
где r - разность энтальпий в состоянии сухого насыщенного пара и в состоянии кипения.
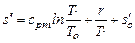 .
.
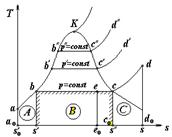
Рис. 8.2. Ts-диаграмма водяного пара
Кривая c-d выражает собой процесс перегрева пара при p = const. Точка d соответствует температуре перегретого пара и энтропии s. В этой области перегретого пара количество теплоты будет равно
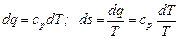 .
.
При сp = cpm = const
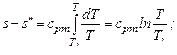
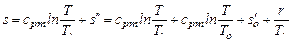 .
.
Линии парообразования при других давлениях 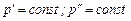 строятся таким же способом.
строятся таким же способом.
Энтальпия пара легко определяется по Ts -диаграмме. Так пл. А представляет удельную энтальпию 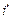 ; пл. В - теплоту испарения - r; пл. С - теплота на перегрев пара. Энтальпия сухого насыщенного пара
; пл. В - теплоту испарения - r; пл. С - теплота на перегрев пара. Энтальпия сухого насыщенного пара 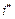 в точке С выражается площадью аоаbcco, а перегретого пара в точке d площадью aoabcddo. Для влажного пара (т. е) энтальпия равна площади aoabeeo.
в точке С выражается площадью аоаbcco, а перегретого пара в точке d площадью aoabcddo. Для влажного пара (т. е) энтальпия равна площади aoabeeo.
8.4. Is - диаграмма водяного пара
Is - диаграмма для влажного водяного пара впервые была предложена Молье в 1904 г. Эта диаграмма обладает рядом преимуществ по сравнению с Ts-диаграммой. Достоинством is -диаграммы является то, что работа и количество теплоты, участвующих в процессах, изображаются отрезками линий, а не площадями, как на Ts -диаграмме. При построении is -диаграммы, рис. 8.3, по оси ординат откладывают энтальпию пара, а по оси абсцисс - удельную энтропию. За начало координат принимается состояние воды в тройной точке, где 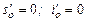 . На диаграмму наносят пограничные кривые жидкости и сухого пара, сходящиеся в критической точке.
. На диаграмму наносят пограничные кривые жидкости и сухого пара, сходящиеся в критической точке.
Состояние воды изображается точками на соответствующих изобарах, которые практически сливаются с пограничной кривой жидкости. Линии изобар в области влажного пара являются практически прямыми наклонными линиями, расходящимися веером от пограничной кривой жидкости.
В изобарном процессе
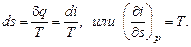
Угловой коэффициент наклона изобары к оси в каждой точке диаграммы численно равен абсолютной температуре данного состояния. Так как в области влажного пара изобара совпадает с изотермой, то согласно последнему уравнению изобары влажного пара являются прямыми линиями: 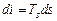 , а это и есть уравнение прямой линии. В области перегретого пара изобары имеют кривизну с выпуклостью, обращенной вниз. На is -диаграмме нанесена изобара АВ, соответствующая давлению в тройной точке р о = 0,000611 МПа.
, а это и есть уравнение прямой линии. В области перегретого пара изобары имеют кривизну с выпуклостью, обращенной вниз. На is -диаграмме нанесена изобара АВ, соответствующая давлению в тройной точке р о = 0,000611 МПа.
В области перегретого пара наносится сетка линий постоянной сухости пара х = const, которые сходятся в критической точке К. Изотермы в области влажного пара совпадают с изобарами. В области перегретого пара они расходятся: изобары поднимаются вверх, а изотермы представляют собой кривые линии, обращенные выпуклостью вверх. При низких давлениях изотермы весьма близки к горизонтальным прямым; с повышением давления кривизна изотермы увеличивается. На диаграмму наносится сетка изохор, которые имеют вид кривых, восходящих вверх более круто по сравнению с изобарами.
Обратимый изохорный процесс в is - диаграмме изображается вертикальной прямой. Поэтому все вертикальные прямые в is-диаграмме представляют собой адиабаты. Область диаграммы, лежащая ниже изобары тройной точки, изображает различные состояния смеси пар + лед. В настоящее время при исследовании тепловых процессов в парах пользуются is -диаграммой и таблицами водяного пара, так как они значительно упрощают расчеты.
Обычно всю is -диаграмму не выполняют, а вычерчивают только верхнюю часть, что дает возможность изображать ее в более крупном масштабе.
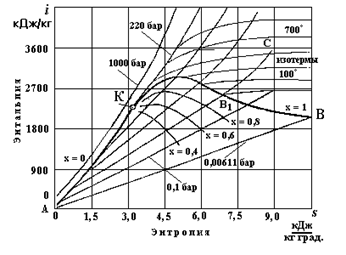
Рис. 8.3. is-диаграмма водяного пара
Date: 2015-05-09; view: 2579; Нарушение авторских прав