
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Политропные процессы и их обобщающее значение
|
|
Политропными называют любые закономерные термодинамические процессы удовлетворяющие уравнению
pv n = const. (6.29)
Каждому политропному процессу соответствует какое-либо значение отношения
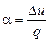 . (6.30)
. (6.30)
Изменение внутренней энергии в политропном процессе можно выразить следующим образом
du = cv dT = a dq,
откуда количество подводимой теплоты будет равно
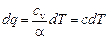 , (6.31)
, (6.31)
где с - теплоемкость газа в политропном процессе
Напишем для политропного процесса уравнение первого закона термодинамики, выраженное через параметры газа
cdT = cv dT + pdv
или
(с - сv)dT - pdv = 0.
Поскольку 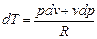 , то
, то 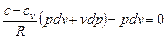 , или
, или
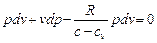 .
.
Заменив в этом выражении R = cp - cv, получим
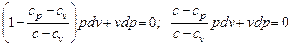 .
.
Для конкретного политропного процесса коэффициент 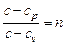 , то
, то 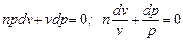 .
.
pv n = const. (6.32)
Это уравнение политропного процесса, который можно рассматривать как обобщающий процесс, так как из этого уравнения при определенных значениях показателя n можно получить все другие процессы, а также и другие возможные.
Очевидно, при n = k получим уравнение адиабатического процесса
pv k = const;
при n = 1 - уравнение изотермического процесса
pv = const;
при n = 0 - уравнение изобарного процесса
p = const.
Для нахождения показателя изохорного процесса извлечем корень n-ой степени из уравнения (6.32)
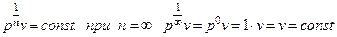 .
.
Следовательно, уравнение изохорного процесса v = const можно получить при n ®  .
.
На рис. 6.4 показано расположение политроп, построенных из одной и той же точки 1, при разных значениях показателя n, который изменяется от +  до -
до -  . Для тепловых машин, кроме изохорного, изобарного, изотермического и адиабатного процессов, имеют большое значение политропные процессы, располагающиеся между изотермическим и адиабатным процессами, как предельными, т. е. с показателем n, лежащим в пределах 1< n < k.
. Для тепловых машин, кроме изохорного, изобарного, изотермического и адиабатного процессов, имеют большое значение политропные процессы, располагающиеся между изотермическим и адиабатным процессами, как предельными, т. е. с показателем n, лежащим в пределах 1< n < k.

Рис. 6.4. Политропные процессы в координатах pv
Для политропных процессов с показателем 1< n < k можно написать зависимости между параметрами, аналогичные зависимостям адиабатного процесса:
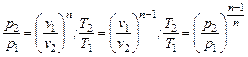 .
.
Работа в политропном процессе равна
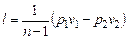 . (6.33)
. (6.33)
Изменение внутренней энергии
D u = cv (T 2 - T 1). (6.34)
Количество теплоты
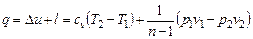 . 6.35)
. 6.35)
Теплоемкость в политропном процессе
 . (6.36)
. (6.36)
Подставляя в (6.37) соответствующие значения n для основных процессов, получим для них выражения теплоемкости с:
- изохорный процесс (n =  ): c = cv;
): c = cv;
- изобарный процесс (n = 0): c = cp;
- изотермический процесс (n =1): c =  ;
;
- адиабатный процесс (n = k): c = 0.
Пример 6.1. Сосуд вместимостью 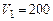 л содержит кислород при абсолютном давлении
л содержит кислород при абсолютном давлении 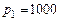 кПа и температуре
кПа и температуре 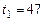 °С. Определить массу газа, конечную температуру, изменение энтропии и количество теплоты, которое необходимо подвести, чтобы повысить давление в процессе при постоянном объеме до
°С. Определить массу газа, конечную температуру, изменение энтропии и количество теплоты, которое необходимо подвести, чтобы повысить давление в процессе при постоянном объеме до 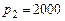 кПа. Удельная теплоемкость – величина переменная.
кПа. Удельная теплоемкость – величина переменная.
Р е ш е н и е. Масса кислорода – по уравнению Клапейрона:
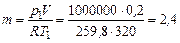 кг.
кг.
Конечная температура для процесса 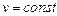 :
:
 К = 367°С.
К = 367°С.
Количество теплоты, сообщенной на изменение внутренней энергии кислорода для процесса 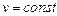 :
:
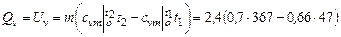 =
= 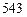 кДж.
кДж.
Изменение энтропии для процесса 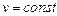 :
:
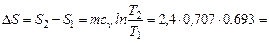 1,17 кДж/К.
1,17 кДж/К.
Пример 6.2. В цилиндре двигателя объемом 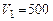 л находится газ (со свойствами воздуха) при избыточном давлении
л находится газ (со свойствами воздуха) при избыточном давлении 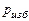 =
=
= 3900 кПа и температуре 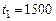 °С. Атмосферное давление
°С. Атмосферное давление 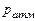 = 100 кПа. От газа отнимается количество теплоты при постоянном давлении до температуры
= 100 кПа. От газа отнимается количество теплоты при постоянном давлении до температуры 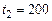 °С. Определить массу газа, конечный объем, изменение внутренней энергии, количество отнятой теплоты, совершенную над газом работу сжатия и изменение энтропии.
°С. Определить массу газа, конечный объем, изменение внутренней энергии, количество отнятой теплоты, совершенную над газом работу сжатия и изменение энтропии.
Р е ш е н и е. Абсолютное давление 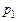 :
:
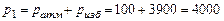 кПа.
кПа.
Масса газа:
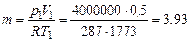 кг.
кг.
Конечный объем для процесса  :
:
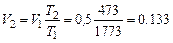 м3 = 133 л.
м3 = 133 л.
Изменение внутренней энергии:
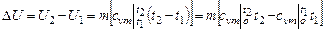 =
=
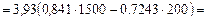 - 4400 кДж.
- 4400 кДж.
Количество отнятой теплоты в процессе  :
:
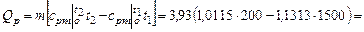
= - 5875 кДж.
Date: 2015-05-09; view: 1279; Нарушение авторских прав