
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теплоемкость при постоянном объеме и давлении
|
|
Как и другие параметры термодинамической системы теплоемкость зависит от характера процесса. Различают теплоемкость при постоянном объеме
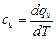 , (5.3)
, (5.3)
равную отношению количества теплоты dqv в процессе при постоянном объеме к изменению температуры dT тела, и теплоемкость при постоянном давлении
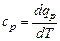 , (5.4)
, (5.4)
равную отношению количества теплоты 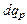 в процессе при постоянном давлении к изменению температуры dT тела.
в процессе при постоянном давлении к изменению температуры dT тела.
В равновесном процессе нагревания тела элементарное количество теплоты, в соответствии с первым законом термодинамики будет
dq = du + dl = du + pdv.
Изменение внутренней энергии du есть полный дифференциал функции состояния, т. е.
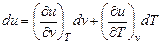 ,
,
подставив который в формулу для первого закона термодинамики, получим

 . (5.5)
. (5.5)
Для процесса v = const изменение dv = 0, тогда (5.5) принимает вид
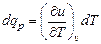 .
.
Тогда, подставив вместо dqv его выражение из (5.3), получим для теплоемкости при v = const следующее выражение
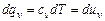 и
и  . (5.6)
. (5.6)
При v =сonst, когда тело не совершает внешней работы, вся теплота, сообщаемая телу, идет на изменение его внутренней энергии, или при cv = const для изменения теплоты в процессе будем иметь
q 1- 2,v = u 2 - u 1 = cv (t 2 - t 1). (5.7)
Изменение внутренней энергии идеального газа равно произведению теплоемкости cv при постоянном объеме на разность температур.
Интегрируя уравнение (5.6) для идеального газа от 0°С до t, получим: 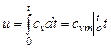 .
.
Отсюда для любого конечного процесса изменения состояния идеального газа имеем
 .
.
Подставим значение du = cvdT в основное уравнение первого закона термодинамики, имеем в общем случае для обратимого процесса при бесконечно малом изменении состояния идеального газа
dq = cv dT + pdv. (5.8)
Для процесса p = const, когда переменными являются Т и v из уравнения первого закона термодинамики получим
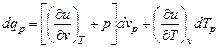 .
.
Поскольку dqp = cp dT, то
 .
.
Но  , тогда будем иметь для теплоемкости при постоянном давлении
, тогда будем иметь для теплоемкости при постоянном давлении
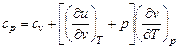 . (5.9)
. (5.9)
Уравнение (5.9) в общем виде устанавливает связь между теплоемкостями сv и сp.
Для идеального газа 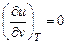 , а
, а 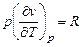 , (что следует из уравнения состояния pv = RT), тогда (5.9) запишется в виде
, (что следует из уравнения состояния pv = RT), тогда (5.9) запишется в виде
cp = cv + R и cp - cv = R.
Это уравнение носит название уравнение Майера.
Оно может быть записано и для кмоль газа:
m Сp - m Сv = 8314,3 Дж/кмоль×град.
Следовательно, для идеальных газов разность между теплоемкостями ср и сv есть величина постоянная.
Для реальных газов ср - сv > R, так как при расширении реальных газов (при р = const) совершается не только внешняя, но и внутренняя работа, связанная с изменением потенциальной энергии тела, что и вызывает больший расход теплоты.
Date: 2015-05-09; view: 1360; Нарушение авторских прав