
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Направление химических процессов
Cистема - закрытая, обменивается теплотой с окружающей средой, Р,T = const, процессы обратимые.
1-ый закон: D U = Q – A пол - P D V (1)
D H = D U + P D V (2)
Подставим (2) в (1):
D H - P D V = Q – A пол - P D V Þ D H = Q – A пол
по 2-ому закону Δ S = Q/T Þ Q = Т Δ S
A пол = -(D H - Т Δ S) Þ
система может совершать работу химического процесса (А пол>0), если (D H - Т Δ S) <0
D G = D H - Т ΔS
G – свободная энергия или изобарно-изотермический потенциал или энергия Гиббса
A пол = -D G – «свободная энергия», та часть теплового эффекта, которую можно превратить в работу.
По мере превращения система теряет способность производить работу и к равновесию ® к «0».
Т Δ S – «связанная энергия», та часть теплового эффекта, которая рассеивается в окружающую среду.
Чем меньше D G (больше A пол ), тем полнее протекает процесс

▼D rG < 0 – самопроизвольный процесс – реакция в прямом направлении;
▼D rG > 0 - самопроизвольный процесс – реакция в обратном направлении;
▼D rG = 0 – система в равновесном состоянии.
Направление протекания процесса зависит от соотношения энтальпийного ∆ rН и энтропийного Т ∆ rS факторов реакции.
D rG = D rH - Т Δ r S
| знак | Принципиальная возможность и условия протекания прямой реакции | |||
| ∆ rН | ∆ rS | Dr G | ||
| - | + | - | Возможна при любой температуре | |
| + | - | + | Невозможна. Возможна в обратном направлении | |
| - | - | - + | Возможна при низких температурах | |
| + | + | + - | Возможна при высоких температурах |

∆ fG (простых веществ) = 0
∆ fG 0 - стандартная энергия Гиббса образования вещества (вещества находятся в стандартном состоянии)
∆ fG 0298, - табулирована [кДж/моль ]
Dr G рассчитывают:
● 1-й способ по закону Гесса:
Δ rGT = ∑ν i Δ fGT,i продуктов - ∑ν j Δ fGT,j исх веществ
Δ rG0298 =∑ν i Δ fG0298,i продуктов-∑ν j Δ fG 0298,j исх веществ
● 2-й способ по уравнению:
Δ rGT = ∆ rHT - T ∆ rST
Δ rG0298 = ∆ rH0298 - T ∆ rS0298
● 3-й способ изотерма Вант Гоффа, 1886г. (связь между Δ rGT и ∆ rG0T): для реакции a Aг + b Bг + d Dк = e Eг + f Fг 
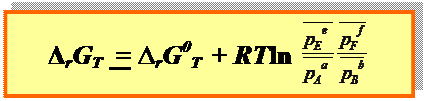 |
 – относительные парциальные давления газообразных веществ.
– относительные парциальные давления газообразных веществ.
∆ rG0Т = ∆ rH0Т - T ∆ rS0Т =
= ∆ rH 0298 + 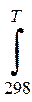 ∆ rС0pdT -Т ∆ rS0 298- Т
∆ rС0pdT -Т ∆ rS0 298- Т 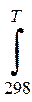
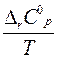 dT
dT
Для приближения ∆ rС0p =0:
∆ rН 0 Т = ∆ rН 0298
∆ rS0T = ∆ rS0 298
∆ rG0Т = ∆ rH0298 - T ∆ rS0298
Задача. Определите возможности самопроизвольного протекания реакции
С(к) + СО2(г) = 2СО(г)
при 298К и 1000К и стандартных состояниях всех компонентов (∆ rН 0 Т и ∆ rS0T - не зависят от температуры).
Решение. Возможность самопроизвольного протекания реакции определяется: ∆ rG0T< 0
∆ rG0Т = ∆ rH0Т - T ∆ rS0Т = ∆ rH0298 - T ∆ rS0298
∆ rG0298 = 172,5 – 298 . 175,66 . 10-3 = 120,15 кДж > 0 - в прямом направлении невозможна (энтальпийный фактор не способствует самопроизвольному протеканию прямой реакции).
∆ rG01000 = 172,5 – 1000 . 175,66 . 10-3 = -3,16 кДж < 0 - в прямом направлении возможна (энтропийный фактор способствует самопроизвольному протеканию прямой реакции).
Задача. При каком соотношении парциальных давлений газообразных компонентов реакции и 298К
С(к) + СО2(г) = 2СО(г)
возможно ее протекание в прямом направлении?
Решение. Возможность самопроизвольного протекания реакции: Δ rG298 <0
По уравнению изотермы Вант-Гоффа:
Δ rG298 =[ ∆rG0298 + RT ln 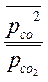 ] < 0.
] < 0.
120,15 + 8,31.10-3.298 ln 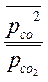 <0
<0
ln 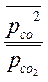 < -48,5 Þ
< -48,5 Þ 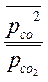 <10-21
<10-21
Задача. Определить температурную область самопроизвольного протекания реакции
Ск + СО2(г) = 2СО(г)
при стандартных состояниях компонентов.
Решение. Реакция протекает самопроизвольно при стандартных состояниях компонентов, если:
∆ rG0Т =∆ rH 0298+ 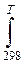 ∆ rС0pdT+Т ∆ rS0 298+ Т
∆ rС0pdT+Т ∆ rS0 298+ Т 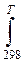 ∆ rС0p/T) dT <0
∆ rС0p/T) dT <0
Если ∆ rH0 и ∆ rS0 не зависят от температуры:
∆ rG0Т = ∆ rH0298 - T ∆ rS0298 < 0.
(172,5 – Т .175,66.10-3) < 0
Т > 982 К
Из справочных данных:
С(графит) 298 – 2300К
СО2 (г) 298 – 2500К
СО (г) 298 – 2500К
область температур: 982 ÷ 2300 К.

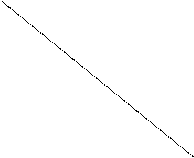 ∆ rG0Т
∆ rG0Т
 |  | ||



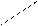

 298 982 2300 Т
298 982 2300 Т
 |
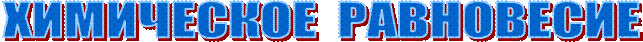

▓ Возможности протекания прямой и обратной реакции равновероятны.
▓ Парциальные давления и концентрации всех компонентов реакции постоянны во времени и во всех точках системы - равновесные давления и концентрации.
При равновесии химической реакции:
a A(г)+ b B(г)+ d D(к)  Û e E(г)+ f F(г)
Û e E(г)+ f F(г)
Δ rGТ = ∆ rG0Т + RT ln 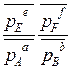 = 0 Þ
= 0 Þ
∆ rG0Т = - RT ln 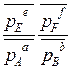
Если реакция a A(р)+ b B(р)+ d D(к)= e E(р)+ f F(р) протекает в идеальном растворе:
∆ rG0Т = - RT ln 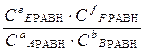
Математическое выражение закона действующих масс для равновесного состояния:
Кс и Кр - константа равновесия

Связь между Кр и Кс:
p v = n RT 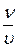 =c p= cRT
=c p= cRT
Кр =  =
= 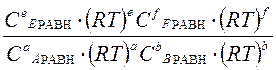
= 
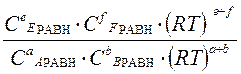
 |
∆ν =(e+f) – (a + b) – изменение числа молей газов в результате реакции,
R = 0,082 атм.л.моль-1.К-1
Выражение Кр - через равновесные количества молей газообразных компонентов ni( равн) и общее давление P 0:
Парциальное давление - pi = 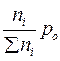
Кр = 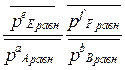 =
= 
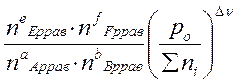
Σni = nE равн + nF равн + nA равн + nB равн
● ∆ rG0Т = - RT ln Кр - для реакций в газовых системах
● ∆ rG0Т =- RT ln Кс - для реакций в конденсированных системах.
Кр и Кс - характеризуют выход продуктов реакции.
Кр и Кс не зависят от:
● парциальных давлений
· концентраций компонентов
· общего давления в системе
но зависят от Т.

∆ rG0Т = - RT ln Кр = ∆ rH0 - T ∆ rS0
ln Kp = - 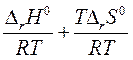 =
= 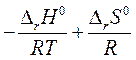
▓ уравнение изобары Вант-Гоффа
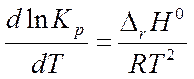
d ln Kp / dT – температурный коэффициент
· если ∆ rH0 < 0 Þ d ln Kp / dT < 0, т.е. с повышением температуры Кр уменьшается Þ равновесие смещается влево
· если ∆ rH0 > 0 Þ d ln Kp / dT > 0, т.е. с повышением температуры Кр увеличивается Þ равновесие смещается вправо
При интегрировании (с учетом ∆ rH0 ¹ f(T)) при Т 2 > Т 1:
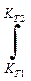

ln  =
= 
чем больше абсолютная величина ∆ rH0, тем сильнее изменяется значение константы равновесия с изменением температуры.

Равновесие смещается:
· при увеличении Т - в сторону эндотермической реакции;
· при увеличении Робщего - в сторону образования меньшего числа молей газообразных реагентов;
· при увеличении Рисходных веществ - в сторону продуктов реакции;
· при уменьшении Сисходных веществ или при увеличении Спродуктов реакции - в сторону исходных реагентов.
▼ Задача. Рассчитать Кр и Кс реакции
С(к) + СО2(г) = 2СО(г)
при 298 К и 1000 К. Сделайте вывод о выходе продукта реакции и определите знак энтальпии реакции.
Date: 2015-05-09; view: 634; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |