
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Первое начало термодинамики. переход системы из состояния I в состояние II:
переход системы из состояния I в состояние II:
 |
- cистема I производит работу (или над нею совершается работа) – W;
- принимает участие в теплообмене с окружающей средой (выделяет или поглощает теплоту) - Q.
По закону сохранения энергии:
Q = DU + W, (1)
Q – количество сообщенной системе теплоты;
D U = U2 – U1 – приращение внутренней энергии;
W – суммарная работа, совершенная системой.
|
U - функция состояния системы
Q – не функция состояния системы
Пусть - только рDV- работа, совершаемая системой против сил внешнего давления (работа расширения)
Для бесконечно малых элементарных процессов уравнение принимает вид:
d Q = dU + рdV (2)
 |
а) изохорный процесс – V = const, тогда dV = 0 и работа расширения системы dW = рdV = 0
первый закон термодинамики:
d QV = dU и QV = U2 – U1 = DU
при данных условиях - QV - функция состояния, т.е. не зависит от пути процесса
б) изобарный процесс - р = const
Qp = D U + р D V
Т.к. D U= U2 – U1, D V = V2 – V1, то Qp = U2 – U1 + рV2- – рV1 = (U2+ рV2) – (U1 + рV1)
Qp = H2 – H1 = D H
 |
Энтальпия – функция состояния (теплосодержание, энергосодержание, включая внутреннюю энергию)
Для идеальных газов: p ∆ V = ∆ν RT,
∆ν – разница между числом молей газообразных продуктов и исходных веществ.
 связь между Qp и QV:
связь между Qp и QV:
Термохимия - часть термодинамики, изучающая тепловые эффекты химических процессов.
Термохимические уравнения - химические уравнения реакций, в которых указаны агрегатные состояния веществ и тепловые эффекты
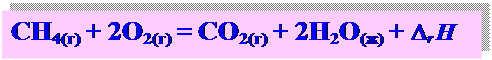 |
Тепловой эффект химической реакции – это изменение энергии системы при протекании реакции, при условии, что система не совершает другой работы, кроме работы расширения.
▼ изохорические условия (V = const)- QV = DU
▼ изобарические условия - тепловой эффект равен
Qp = H2 – H1 = D r H - энтальпия реакции
Если вещества находятся в стандартном состоянии – стандартная энтальпия реакции D r H 0
Date: 2015-05-09; view: 715; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |