
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энергия превращение
Химический процесс - это два одновременно происходящих явления:
1) передача энергии
2) изменение в упорядоченности расположения частиц относительно друг друга (в изолированной системе.
▼Самопроизвольный процесс может протекать только с выделением тепла;
► Движущие силы и критерии протекания самопроизвольных химических процессов
· Стремление частиц (молекул, ионов, атомов) к хаотическому движению.
· Стремление системы – к переходу от более упорядоченного состояния к менее упорядоченному.
· Состояние системы можно охарактеризовать микросостояниями составляющих ее частиц, т.е. их мгновенными координатами и скоростями различных видов движения в различных направлениях.

Состояние системы характеризуют микросостояниями ее частиц (мгновенными координатами и скоростями в различных направлениях).

W – огромное число, т.к., напр. в 1 моль – 6,02•1023 частиц, поэтому используют lnW
Чем больше число микросостояний, тем более вероятна реализация состояния
S = k lnW
k –постоянная Больцмана
k = R/N =1,38×10-23 Дж/К

Акрист ® Ааморф D S > 0
 S 0298(O) = 161 Дж/(моль·К) за счет усложнения
S 0298(O) = 161 Дж/(моль·К) за счет усложнения
S 0298(O2) = 205 Дж/(моль·К) состава молекул
S 0298(O3) = 238,8 Дж/(моль·К)
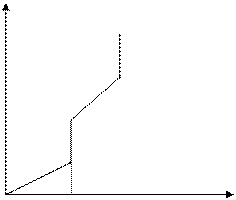 S вещества растет с ростом температуры и скачкообразно увеличивается в точках фазовых переходов
S вещества растет с ростом температуры и скачкообразно увеличивается в точках фазовых переходов
S
Тпл Ткип Т
S – функция состояния системы
|
● D S (процессов) > 0 – переход из более упорядоченного состояния в менее упорядоченное - самопроизвольное протекание процесса вероятно (расширение газов, плавление, растворение).
● D S (процессов) < 0 – самопроизвольное протекание маловероятно (сжатие газов, конденсация)
▼Стандартная энтропия – S 0 (Дж/моль×К)-
Date: 2015-05-09; view: 529; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |