
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Вывод уравнения состояния. Закон Дальтона. Закон Авогадро
|
|
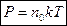 ,
, 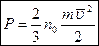 - основное уравнение молекулярно-кинетической теории идеального газа.
- основное уравнение молекулярно-кинетической теории идеального газа.
Отсюда можно получить уравнение состояния идеального газа:
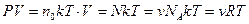 Þ
Þ 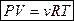 - уравнение состояния идеального газа.
- уравнение состояния идеального газа.
Если имеется смесь газов, то 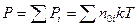 - закон Дальтона (Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений)
- закон Дальтона (Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений)
Закон Авогадро: В равных объемах газов (V) при одинаковых условиях (температуре Т и давлении Р) содержится одинаковое число молекул.
Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём.
В частности, при нормальных условиях, т.е. при 0° С (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л/моль. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Менделеева-Клапейрона:
. 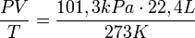
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
Используя распределение молекул по высоте Ж.Перрен экспериментально определил постоянную Авогадро. Он исследовал под микроскопом распределение броуновских частиц, т.е. считал под микроскопом число таких частиц на разных высотах в сосуде. Частицы были помещены в жидкость, плотность которой лишь на немного меньше плотности материала частиц, для того чтобы тяжелые частицы не «осели на дно», а распределились в достаточно большом слое по высоте.
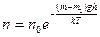 , где
, где 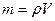 - масса частицы,
- масса частицы, 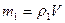 - масса вытесненной воды.
- масса вытесненной воды.
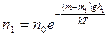 ,
, 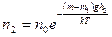 Þ
Þ 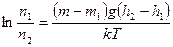 Þ
Þ
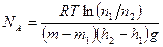 .
.
71.72.(не разделены!)Распределение Больцмана.
(72)Барометрическая формула.
При выводе основного уравнения молекулярно-кинетической теории газов и макcсвелловского распределения молекул по скоростям предполагалось, что на молекулы газа внешние силы не действуют, поэтому молекулы равномерно распределены по объему. Однако молекулы любого газа находятся в потенциальном поле тяготения Земли. Тяготение, с одной стороны, и тепловое движение молекул — с другой, приводят к некоторому стационарному состоянию газа, при котором давление газа с высотой убывает.
Выведем закон изменения давления с высотой, предполагая, что поле тяготения однородно, температура постоянна и масса всех молекул одинакова. Если атмосферное давление на высоте А равно р (рис. 67), то на высоте h + dh оно равно p+dp (при dh>0 dp<0, так как давление с высотой убывает). Разность давлений р и p + dp равна весу газа, заключенного в объеме цилиндра высотой Ah с основанием площадью, равной единице площади:
р- (p +d p)=r gh,
где r — плотность газа на высоте h (dh настолько мало, что при изменении высоты в этом пределе плотность газа можно считать постоянной). Следовательно,
dр=-rgdh. (45.1)
Воспользовавшись уравнением состояния идеального газа pV = (m/M)RT (т — масса газа, М —молярная масса газа),находим, что
Подставив это выражение в (45.1), получим
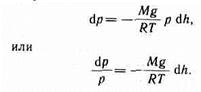
С изменением высоты от h 1 до h 2. давление изменяется от р 1 до p 2 (рис. 67), т. е.
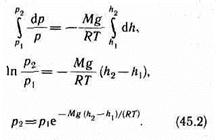
Выражение (45.2) называется барометрической формулой. Она позволяет найти атмосферное давление в зависимости от высоты или, измерив давление, найти высоту. Так как высоты обозначаются относительно уровня моря, где давление считается нормальным, то выражение (45.2) может быть записано в виде
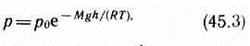
где р — давление на высоте h.
Прибор для определения высоты над земной поверхностью называется высотомером (или альтиметром). Его работа основана на использовании формулы (45.3). Из этой формулы следует, что давление с высотой убывает тем быстрее, чем тяжелее газ.
Барометрическую формулу (45.3) можно преобразовать, если воспользоваться выражением (42.6) p=nkT:

где n — концентрация молекул на высоте h, n 0 — то же на высоте h=0. Так как M = m 0 N A (NA — постоянная Авогадро, m 0 — масса одной молекулы), а R=kNA, то
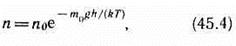 где m0gh=П — потенциальная энергия молекулы в поле тяготения, т. е.
где m0gh=П — потенциальная энергия молекулы в поле тяготения, т. е.
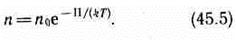
Выражение (45.5) называется распределением Больцмана во внешнем потенциальном поле. Из него следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул.
Если частицы имеют одинаковую массу и находятся в состоянии хаотического теплового движения, то распределение Больцмана (45.5) справедливо в любом внешнем потенциальном поле, а не только в поле сил тяжести.
Date: 2015-05-09; view: 3803; Нарушение авторских прав