
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

I начало термодинамики в изохорическом процессе
|
|
I начало ТД для изохорического процесса: количество теплоты, передаваемое системе, идет на изменение внутренней энергии системы. С учетом теплоемкости выглядит так: 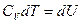 .
.
Изменение внутренней энергии одного моля идеального газа, с учетом молярной теплоемкости и калорического уравнения состояния  .
.
Для 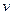 молей вещества
молей вещества 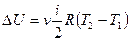 .
.
16.Изобарический процесс: уравнение, график в PV, PT, VT координатах.
Изобарический процесс - процесс, происходящий при постоянном давлении.
Для изобарического процесса объем и температура связаны между собой законом Гей-Люссака 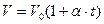 , где
, где 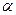 - термический коэффициент объемного расширения,
- термический коэффициент объемного расширения, 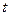 - температура в градусах Цельсия.
- температура в градусах Цельсия.
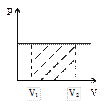 Это уравнение на диаграмме состояний в
Это уравнение на диаграмме состояний в 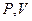 -координатах представляет собой прямую параллельную оси
-координатах представляет собой прямую параллельную оси 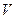 , а на диаграмме в
, а на диаграмме в 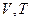 -координатах представляет собой прямую, как бы выходящую из начала координат. В общем случае при
-координатах представляет собой прямую, как бы выходящую из начала координат. В общем случае при  закон не выполняется, т.к. газы переходит в жидкое состояние (за исключением гелия). Если температуру будем откладывать в Цельсиях, то изохора как бы пересечет ось
закон не выполняется, т.к. газы переходит в жидкое состояние (за исключением гелия). Если температуру будем откладывать в Цельсиях, то изохора как бы пересечет ось 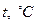 температур в точке
температур в точке 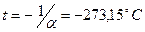 . Аналогично уравнению изохорического процесса, закон Гей-Люссака имеет и другой более удобный вид:
. Аналогично уравнению изохорического процесса, закон Гей-Люссака имеет и другой более удобный вид: 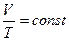 .
.
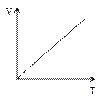 При изменении состояния идеального газа с
При изменении состояния идеального газа с 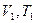 на состояние
на состояние 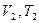 согласно закону Гей-Люссака получим уравнение процесса
согласно закону Гей-Люссака получим уравнение процесса 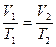 , связывающее параметры начального и конечного состояния идеального газа.
, связывающее параметры начального и конечного состояния идеального газа.
Для этого процесса 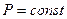 Þ
Þ  . Система совершает работу при расширении от объема
. Система совершает работу при расширении от объема 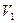 до объема
до объема 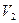 , температура системы соответственно изменяется от
, температура системы соответственно изменяется от 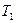 до
до 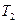 графически эту работу можно представить, как площадь под графиком процесса в
графически эту работу можно представить, как площадь под графиком процесса в
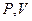 -координатах. Вычислим интеграл и получим выражение для работы:
-координатах. Вычислим интеграл и получим выражение для работы:
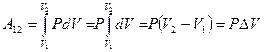 Þ
Þ 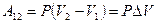 .
.
Выразим работу через изменение температуры. Запишем систему из уравнений состояния моля идеального газа и: 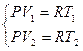 , отнимем от второго уравнения первое
, отнимем от второго уравнения первое
 , отсюда получим
, отсюда получим
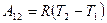 .
.
Для 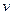 молей вещества:
молей вещества: 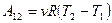
Изменение внутренней энергии в этом процессе 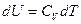 Þ
Þ 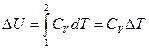 .
.
Для 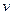 молей вещества
молей вещества 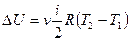 .
.
Date: 2015-05-09; view: 1417; Нарушение авторских прав