
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Число степеней свободы молекул. Выражение для внутренней энергии идеального газа
|
|
Для не слишком крайних условий явный вид функции 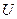 для идеального газа может быть определен исходя из теоремы о равнораспределении энергии по степеням свободы. Уточним, что степенями свободы называют независимые переменные. Число степеней свободы
для идеального газа может быть определен исходя из теоремы о равнораспределении энергии по степеням свободы. Уточним, что степенями свободы называют независимые переменные. Число степеней свободы 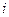 это число независимых переменных полностью задающих положение тела в пространстве.
это число независимых переменных полностью задающих положение тела в пространстве.
Теорема: на каждую степень свободы молекул при поступательном и вращательном движении приходится 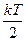 энергии. На колебательную степень свободы -
энергии. На колебательную степень свободы - 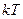 энергии.
энергии.
Энергия колебательных движений системы очень велика, она обусловлена относительным смещением ядер, и тепловое движение при обычных температурах не может возбуждать колебательные степени свободы молекул системы. Тогда, т.к. 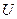 энергия всех частиц системы, то внутренняя энергия для одного моля вещества идеального газа:
энергия всех частиц системы, то внутренняя энергия для одного моля вещества идеального газа:
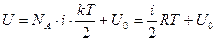 , учли, что
, учли, что 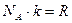 , т.к. постоянная Больцмана это универсальная газовая постоянная на одну молекулу.
, т.к. постоянная Больцмана это универсальная газовая постоянная на одну молекулу. 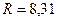 Дж/моль·К,
Дж/моль·К, 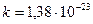 Дж/К.
Дж/К.
Тогда явный вид зависимостей для молярных теплоемкостей в процессах при постоянном объеме и давлении над идеальным газом:
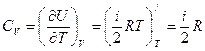
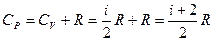 .
.
Мы видим, что достаточно знать для данной системы сорт молекул и количество степеней свободы молекулы, чтобы вычислить значения молярных теплоемкостей и внутреннюю энергию моля вещества.
| Вид молекул |
 число степеней свободы число степеней свободы
| 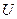 на 1 моль вещества на 1 моль вещества
|
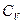
|
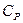
| 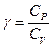
|
| Одноатомные | (поступательные ст.св.) | 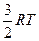
| 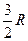
| 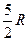
| 
|
| Двухатомные | (3 пост.+2 вращательные ст. св.) | 
| 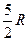
| 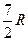
| 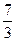
|
| Трехатомные и многоатомные | (3 пост.+3 вращательные ст. св.) | 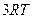
| 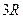
| 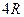
| 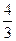
|
1. Одноатомная молекула - 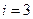 ст.св. (поступательного движения).
ст.св. (поступательного движения).
2. Двухатомная молекула - 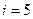 ст.св. (3 поступ.+2 вращательного движения)
ст.св. (3 поступ.+2 вращательного движения)
3. Трехатомная молекула - 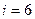 ст.св. (3 поступ. +3 вращ.)
ст.св. (3 поступ. +3 вращ.)
14.Изохорический процесс: уравнение, график в PV, PT, VT координатах.
Изохорический процесс - процесс, происходящий при постоянном объеме.
Для изохорического процесса давление и температура связаны между собой законом Гей-Люссака 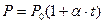 , где
, где 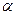 - термический коэффициент изменения давления,
- термический коэффициент изменения давления, 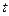 - температура в градусах Цельсия.
- температура в градусах Цельсия.
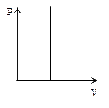
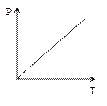 Это уравнение на диаграмме состояний в
Это уравнение на диаграмме состояний в 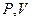 -координатах представляет собой прямую параллельную оси
-координатах представляет собой прямую параллельную оси 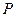 , а на диаграмме в
, а на диаграмме в 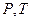 -координатах представляет собой прямую, как бы выходящую из начала координат, если температуру по оси
-координатах представляет собой прямую, как бы выходящую из начала координат, если температуру по оси 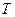 , будем откладывать в Кельвинах. Если температуру будем откладывать в Цельсиях, то изохора пересечет ось
, будем откладывать в Кельвинах. Если температуру будем откладывать в Цельсиях, то изохора пересечет ось 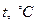 температур в точке
температур в точке 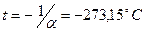 . Отсюда
. Отсюда 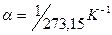 .
.
Закон Гей-Люссака имеет и более удобный вид: 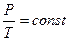 .
.
 При изменении состояния идеального газа с
При изменении состояния идеального газа с 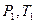 на состояние
на состояние 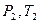 согласно закону Гей-Люссака получим уравнение процесса
согласно закону Гей-Люссака получим уравнение процесса 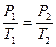 , связывающее параметры начального и конечного состояния идеального газа.
, связывающее параметры начального и конечного состояния идеального газа.
Для этого процесса 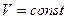 Þ
Þ 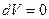 Þ
Þ 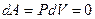 .
.
Система не совершает работу, следовательно, количество теплоты, передаваемое системе, идет на изменение ее внутренней энергии 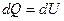 .
.
Date: 2015-05-09; view: 1339; Нарушение авторских прав