
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теплоемкость. Теплоемкость газов в изохорных и изобарных процессах
|
|
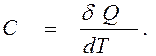 | 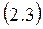 | ||
Теплоемкость системы (обычно обозначаемая символом С) определяется количеством теплоты, которое необходимо передать системе для того, чтобы повысить ее температуру на один градус температурной шкалы. Поскольку теплоемкость может быть функцией температуры, то отношение подведенной в систему теплоты к вызванному ею приращению температуры следует брать в дифференциальной форме, то есть
Из определения теплоемкости видно, что теплоемкость (через теплоту Q) зависит от условий передачи теплоты термодинамической системе, то есть теплоемкость является функцией процесса, в котором в термодинамическую систему поступает теплота.
Особенно хорошо это видно при рассмотрении теплоемкости газов. Так как элементарная работа газа против внешних сил может быть записана в виде dA = PdV, то если в процессе поступления в систему теплоты объем поддерживается постоянным (то есть dV = 0), тогда вся подводимая теплота идет только на изменение внутренней энергии. В этом случае мы имеем дело с теплоемкостью при постоянном объеме, которая оказывается просто производной от
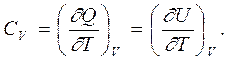 |  | ||
внутренней энергии по температуре
Теперь изменение внутренней энергии газа можно записать в следующем виде:
dU = CvdT (2.5)
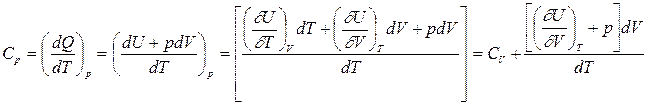
Если процесс передачи теплоты идет при неизменном давлении, то мы имеем дело с теплоемкостью при постоянном давлении СР
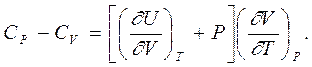 |  | ||
то есть Ср отличается от Сv на величину
В этом уравнении внутренняя энергия системы U рассматривается как функция объема V и температуры Т, а объем – как функция температуры Т при постоянном давлении.
Тот факт, что внутреннюю энергию газа можно представить как функцию двух параметров, а не трех (Т, Р, V), обусловлен существованием между этими параметрами связи (1.1), именуемой уравнением состояния, что позволяет исключить любой из трех термодинамических параметров. Таким образом, все функции состояния термодинамической системы могут быть представлены как функции параметров, число которых на единицу меньше их полного числа, так как один из параметров всегда выражается через другие в силу существования уравнения состояния.
Этот параграф мы завершим записью первого начала термодинамики в часто используемой форме уравнения, выражающего общефизический закон сохранения энергии для газообразного состояния тел (без учета электромагнитных влияний)
dQ = CvdT + РdV (2.7)
Это уравнение широко используется в термодинамике при изучении особенностей теплового поведения тел, когда привлекается для этого модель идеального газа или газа Ван-дер-Ваальса (о чем подробнее будет сказано ниже в главе 8).
Date: 2015-05-09; view: 1088; Нарушение авторских прав