
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Массовое и зарядовое число
|
|
По Э. Резерфорду, атом состоит из положительно заряженного ядра и окружающих его электронов, причем ядра имеют размеры примерно 10-14 -10-15 м (линейные размеры атома примерно 10-10м). Атомное ядро состоит из элементарных частиц - протонов и нейтронов. Протон (р) имеет положительный заряд, равный заряду электрона, и массу покоя mp =1,6726×10-27кг»1836mе, где me -масса электрона. Нейтрон (n) - нейтральная частица с массой покоя m =1,6749×10 -27кг»1838me. Протоны и нейтроны называются нуклонами. Общее число нуклонов в атомном ядре называется массовым числом А.
Атомное ядро характеризуется зарядом Zе, где Z - зарядовое число ядра, равное числу протонов в ядре и совпадающее с порядковым номером химического элемента в периодической системе Менделеева, e - заряд протона. Известные в настоящее время 107 элементов таблицы Менделеева имеют зарядовые числа ядер от Z =1 до Z =107.
Ядро обозначается тем же символом, что и нейтральный атом: 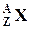 , где А – массовое число (число нуклонов в ядре); Z - атомный номер (число протонов в ядре), Х - символ химического элемента,
, где А – массовое число (число нуклонов в ядре); Z - атомный номер (число протонов в ядре), Х - символ химического элемента,
Так как атом нейтрален, то заряд ядра определяет и число электронов в атоме. От числа электронов зависит их распределение по состояниям в атоме, от которого, в свою очередь, зависят химические свойства атома. Следовательно, заряд ядра определяет специфику данного химического элемента, т.е. определяет число электронов в атоме, конфигурацию их электронных оболочек, величину и характер внутриатомного электрического поля. Ядра с одинаковыми Z, но разными А (то есть с разными числами нейтронов N=A-Z) называются изотопами, а ядра с одинаковыми А, но разными Z – изобарами. Например, водород (Z=1) имеет три изотопа: 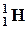 - протий (Z=1, N=0),
- протий (Z=1, N=0), 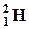 - дейтерий (Z=1, N=1),
- дейтерий (Z=1, N=1), 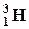 - тритий (Z=1, N=2). В подавляющем большинстве случаев изотопы одного и того же химического элемента обладают одинаковыми химическими и почти одинаковыми физическими свойствами (исключение составляют, например, изотопы водорода), определяющимися в основном структурой электронных оболочек, которая является одинаковой для изотопов данного элемента.
- тритий (Z=1, N=2). В подавляющем большинстве случаев изотопы одного и того же химического элемента обладают одинаковыми химическими и почти одинаковыми физическими свойствами (исключение составляют, например, изотопы водорода), определяющимися в основном структурой электронных оболочек, которая является одинаковой для изотопов данного элемента.
Date: 2015-05-08; view: 1275; Нарушение авторских прав