
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Значение волновой функции
|
|
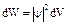
dV- объем, в котором находится частица.
dW- вероятность нахождения частицы в заданном объеме.
Т.к. электрон в атоме имеет три степени свободы (i=3), то 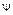 является функцией трех квантовых чисел (
является функцией трех квантовых чисел (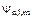 ).
).
n- главное квантовое число (n=1,2,3…).
l- азимутальное (орбитальное) квантовое число (l=0,1,2,…,n-1). l принимает n различных значений.
m- магнитное квантовое число (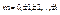 ). m принимает 2l+1 различных значений.
). m принимает 2l+1 различных значений.
Сколько может быть различных состояний электрона с одним и тем же значением n?
 Не может быть двух состояний (электронов), в которых все квантовые числа одинаковые.
Не может быть двух состояний (электронов), в которых все квантовые числа одинаковые.
Под термином: «различные квантовые состояния» понимаются состояния, которые отличаются значение хотя бы одного квантового числа.
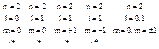 Это есть принцип Паули для электрона в атоме (n2).
Это есть принцип Паули для электрона в атоме (n2).
(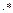 )-обозначение двух противоположных направления собственных спиновых моментов (Mzs).
)-обозначение двух противоположных направления собственных спиновых моментов (Mzs).
Состояние с l=0 называется s–состоянием; с l=2 называется р–состоянием; с l=3 называется d–состоянием.
Физический смысл квантовых чисел.
1. n- главное квантовое число (=1,2,3…). Определяет энергию 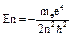 . Данная величина дискретная, строго определенная.
. Данная величина дискретная, строго определенная.
2. l- азимутальное (орбитальное) квантовое число (l=0,1,2,…,n-1). Определяет момент импульса на орбите (орбитальный механический момент). Определяет форму орбиты.
Рис.1.8.
М 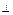 плоскости орбиты. Из уравнения Шредингера следует
плоскости орбиты. Из уравнения Шредингера следует 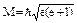 . Данная величина дискретная, строго определенная.
. Данная величина дискретная, строго определенная.
3. m- магнитное квантовое число (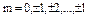 ). Определяет проекцию момента импульса на ось. Определяет ориентацию орбиты в пространстве. Mz=m
). Определяет проекцию момента импульса на ось. Определяет ориентацию орбиты в пространстве. Mz=m 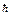 - дискретная величина.
- дискретная величина.
Рис.1.9.
Пример.
Электрон находится в р-состянии (l=1, m=0, 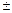 1). Следовательно, Mz=0, Mz=+
1). Следовательно, Mz=0, Mz=+ 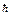 ;-
;- 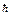
Итак.
1. 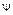 , описывающая поведение электрона в атоме, является функцией трех квантовых чисел, так как электрон в атоме имеет три степени свободы.
, описывающая поведение электрона в атоме, является функцией трех квантовых чисел, так как электрон в атоме имеет три степени свободы.
2. В каждом квантовом состоянии, которому соответствуют определенные значения квантовых чисел l, m и n, электрон обладает определенными (дискретными) значениями трех характеристик: En, M, Mz.
3. В 1930г. Гауцмитом и О… было установлено, что электрон обладает собственным механическим моментом, который получил название спина.
Msz=ms 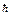 ; ms=
; ms= 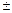 S
S
ms- спиновое магнитное квантовое число.
S- спиновое число.
Sэл=1/2; Mzs= 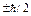
Mzs- проекция на заданное направление.
Полный момент электрона 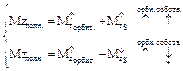
4. С у четом спина полный набор квантовых чисел есть n,l,m. Первые три связаны с движением электрона в атоме, четвертый – с собственным свойством электрона.
Полный набор собственных характеристик электрона тоже 4: E, M, Mzs, Mz.
5. Так как в каждом квантовом состоянии электрон имеет две ориентации спина, то число различных квантовых состояний, соответствующих определенному значению n будет 2n2 – принцип Паули для электрона в атоме.
6. Так как 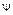 зависит от квантовых чисел, смысл которых разобран, то, следовательно, известно значение
зависит от квантовых чисел, смысл которых разобран, то, следовательно, известно значение 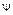 . А, зная
. А, зная 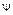 , можно рассчитать вероятность обнаружения электрона в атоме водорода в различных квантовых состояниях.
, можно рассчитать вероятность обнаружения электрона в атоме водорода в различных квантовых состояниях.
Рис.2.
Следовательно, радиусы боровских орбит соответствуют расстояниям, на которых максимальна вероятность обнаружения электрона в атоме, но электрон может быть ближе и дальше этого расстояния с меньшей вероятностью. Следовательно, движение электрона в атоме есть некое электронное облако (форму определяет l), плотность которого максимальна на расстояниях, соответствующих боровским радиусам орбит. Вкладывая такой смысл в боровские радиусы, можно сохранить понятие орбит.
7. Отличительные особенности квантовой механики: вероятность поведения частиц, и дискретность всех характеристик частиц.
Рис.2.1
Date: 2015-05-08; view: 587; Нарушение авторских прав