
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Краткая теория. Парообразованием называется переход вещества из конденсированной фазы (жидкой или твердой) в газовую
|
|
Парообразованием называется переход вещества из конденсированной фазы (жидкой или твердой) в газовую, для осуществления которого веществу необходимо подвести определенное количество теплоты.
Различают следующие виды парообразования: испарение - парообразование со свободной поверхности жидкости (в случае твердого тела – сублимация) и кипение - парообразование, которое происходит не только со свободной поверхности жидкости, но и изнутри самой жидкости.
Явление испарения объясняется тем, что молекулы жидкости, обладающие кинетической энергией, большей потенциальной энергии взаимодействия соседних молекул жидкости, преодолевают силы молекулярного сцепления и вылетают с её поверхности, что ведёт к уменьшению внутренней энергии жидкости, т. е. к ее охлаждению. Чтобы процесс испарения протекал при постоянной температуре, необходимо сообщать каждой единице массы вещества определенное количество теплоты. Обратный процесс перехода пара в жидкость называется конденсацией.
Процессы испарения и конденсации идут одновременно. Когда число молекул, покидающих жидкость и возвращающихся в нее за одно и то же время одинаковы, наступает состояние динамического равновесия. Пар в состоянии динамического равновесия с жидкостью называется насыщенным.
При повышении температуры плотность и давление насыщенного пара увеличиваются.
Для осуществления процесса испарения необходимо наличие поверхностного раздела между жидкостью и вакуумом (или газом). Но эту поверхность можно получить и внутри жидкости, так как любая жидкость способна в той или иной степени поглощать газы. При нагревании растворенные в жидкости газы и газы из стенок сосуда начинают выделяться в виде пузырьков. На каждый пузырек действует гидростатическое давление столба жидкости над ним, внешнее атмосферное давление, добавочное и направленное внутрь пузырька давление за счет кривизны его поверхности, которые стараются его раздавить. Однако внутрь пузырька идет испарение жидкости и давление в нем растет при повышении температуры. Когда температура жидкости достигает значения, при котором упругость (давление) насыщенных паров жидкости в пузырьке становится чуть выше внешнего давления (точнее, суммы вышеуказанных давлений, которые стремятся его раздавить), пузырек начинает быстро раздуваться, резко увеличивается выталкивающая сила, он быстро всплывает наружу и лопается, выбрасывая насыщенный пар наружу. Этот процесс бурного выделения паров изнутри жидкости называется кипением.
Итак, кипение жидкости наступает в том случае, когда температура всей жидкости одинакова, а давление насыщенного пара этой жидкости равно внешнему давлению. Температура, при которой происходит кипение жидкости, находящейся под постоянным давлением, называется температурой кипения. При увеличении давления температура кипения увеличивается, при уменьшении давления – уменьшается.
Чтобы жидкость кипела, необходимо нагреть её до температуры кипения, а затем сообщить добавочное количество тепловой энергии. Количество теплоты, необходимое для превращения в пар единицы массы m жидкости, нагретой до температуры кипения, называется удельной теплотой парообразования r:
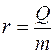 . (1)
. (1)
При обратном переходе молекул из пара в жидкость происходит конденсация. Конденсация и испарение относятся к фазовым переходам 1-го рода, когда скачком меняется плотность вещества, а в единице массы выделяется или поглощается определенное количество теплоты. В равновесном изобарно-изотермическом фазовом переходе испарение-конденсация единицей массы вещества поглощается (при испарении) и выделяется (при конденсации) одинаковое количество теплоты, называемое удельной теплотой парообразования или конденсации соответственно.
Для определения удельной теплоты парообразования исследуемой жидкости пользуются калориметрическим методом, схема которого показана на рис. 1.
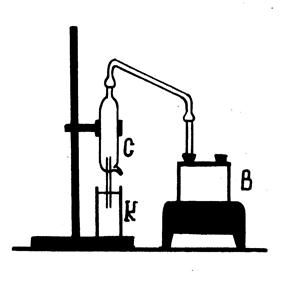 Рис. 1
Рис. 1
| Пар, образующийся в колбе-парообразо- вателе В при кипении воды, поступает в сухопарник С, где осаждаются успевшие сконденсироваться на стенках трубки капельки воды. Осушенный пар по трубке поступает в калориметр К с водой, где конденсируется, нагревая при этом воду. Температура воды в калориметре измеряется спиртовым термометром. Калориметр (от лат. calor - тепло и греч. metreo - измеряю) - это вставленные друг в друга металлические стаканы, между которыми имеется воздушный промежуток, уменьшающий потери тепла за счет низкой теплопроводности воздуха. Пусть вода массой mв налита во внут- |
ренний стакан калориметра массой mст, температура воды и стакана одинакова и равна t 1. Водяной пар с температурой t к, попав в воду, конденсируется, и внутренний стакан калориметра с водой нагревается до температуры смеси t 2. Масса m к конденсата - водяного пара, сконденсировавшегося во внутреннем стакане калориметра, равна разности масс внутреннего стакана калориметра с водой после конденсации туда пара m 2 и до конденсации m 1: m к = m 2 – m 1.
Предполагая‚ что тепловой обмен происходит без потери тепла в окружающую среду, можно составить уравнение теплового баланса
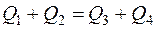 , (2)
, (2)
где левая часть уравнения определяет количество теплоты, выделившееся при конденсации пара и остывании образовавшейся из пара воды (конденсата) в калориметре до температуры смеси t 2, а правая часть – количество теплоты, принятое калориметром и водой.
В уравнении (2) количества теплоты определяются следующим образом:
Q 1 = r ·m к - количество теплоты, отданное паром при конденсации его в воду при температуре кипения t к; m к – масса сконденсированного пара (конденсата);
Q 2= св ·m к (t к – t 2) - количество теплоты, выделенное при охлаждении конденсата m к от температуры конденсации t к до температуры смеси t 2;
Q 3= св ·mв (t 2 – t 1) – количество теплоты, полученное водой массой mв в калориметре при конденсации пара и остывании конденсата;
Q 4= сст·mст (t 2 – t 1) – количество теплоты, полученное внутренним сосудом калориметра массой m ст;
св и сст – удельные теплоемкости воды и материала калориметра соответственно;
mст - масса внутреннего сосуда калориметра;
mв – масса воды в калориметре;
t 1 – начальная температура воды (и калориметра);
t 2 – температура смеси воды и конденсата;
t к – температура пара (равная температуре кипения воды).
Подставив значения Q 1, Q 2, Q 3, Q 4 в (2), получим
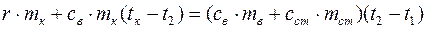 ,
,
откуда
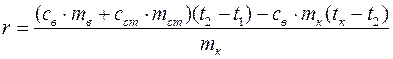
| (3) |
Date: 2015-05-08; view: 924; Нарушение авторских прав