
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Второе начало термодинамики. До сих пор рассматривались только так называемые обратимые или равновесные процессы
|
|
До сих пор рассматривались только так называемые обратимые или равновесные процессы. В равновесных процессах, как уже говорилось, система (газ) находится в равновесии с окружающими телами и без совершения работы или передачи теплоты своего состояния не меняет.
Оказывается, что понятие и формулы вычисления энтропии применимы и к неравновесным, необратимым процессам. Такие процессы характерны тем, что в одном направлении они протекают самопроизвольно, без совершения работы или передачи теплоты, а вот чтобы вернуть системы в первоначальное состояние, совершение работы или передача теплоты, в общем затрата энергии, обязательны.
Такие процессы окружают нас повседневно. Чашка сама собой разбивается, а вот склеить ее — целое дело. Явления старения и множество других — все это примеры необратимых процессов. Такие явления важны, например, в биофизике.
Все необратимые процессы называются так потому, что в них важно, как направлено время. Время течет так, как идет необратимый процесс.
Энтропия является характеристикой необратимых процессов.
Второе начало термодинамики (второй закон термодинамики) заключается в том, что во всех неравновесных процессах, протекающих в замкнутых системах, энтропия повышается.
Таким образом, как понятие о внутренней энергии позволяет ввести первое начало термодинамики, так и понятие об энтропии позволяет ввести второе начало. Оказывается, что формулы термодинамики, записанные ранее, верны и в случае необратимых процессов, причем для этих процессов Δ S > 0 (энтропия повышается). Это положение впервые сформулировал Джозеф Гиббс.
Используем теперь формулу S = k ln Γ, выражающую энтропию через число состояний Γ. Возрастание энтропии означает, что самопроизвольно протекают процессы, приводящие к увеличению числа состояний. Само собой происходит уменьшение упорядоченности, увеличение беспорядочности. Сам собой возникает хаос. Если где-то наблюдается увеличение упорядочености, например, строят дом, то это означает, что где-то в другой части замкнутой системы происходит разупорядочивание, порча, смешивание, загрязнение. Там добывают песок, глину, рубят лес, затрачивают энергию на изготовление кирпича, распиловку и т. д.
Чтобы что-нибудь сломалось, ничего делать не надо, нужно только подождать — обязательно сломается. Чтобы дольше не ломалось, нужно затрачивать деньги, энергию, усилия, которые должны черпаться из других частей замкнутой системы. Такая система, в результате, еще быстрее разрушается, хаотизируется. Каждый шаг есть шаг к смерти. Это закон природы. Как бы он нам не был противен, этот закон верен. Правда, само существование Вселенной (с большой буквы), вроде, противоречит этому закону, а Вселенная существует долго, и на наш век хватит.
В заключение рассмотрим «машину». Именно для объяснения действия машин (тепловых машин) и создавалась первоначально термодинамика.
В тепловой машине (рис. 2.7) теплота Q 1забирается от нагревателя (топки, реактора и т. д.), находящегося при высокой температуре Т 1, и передается в место с меньшей температурой Т 2(холодильник), такой процесс происходит сам собой (самопроизвольно). Ясно, что и в холодильник попадет некоторое количество теплоты Q 2. Разность теплоты Q 1 – Q 2 = А и есть та полезная работа, ради получения которой строят машины.
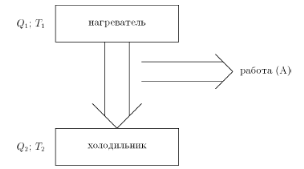
Рис. 2.7. Тепловая машина
Основной характеристикой любой машины является ее коэффициент полезного действия (КПД):
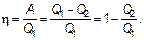 (2.32)
(2.32)
Инженеры стремятся получить КПД побольше. Второе начало термодинамики позволяет указать КПД ηид, выше которого получить невозможно.
Второе начало термодинамики в применении к тепловой машине должно быть записано как S 2 > S 1или в соответствии с определением (см. (2.21))
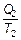 ≥
≥ 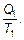 (2.33)
(2.33)
Ведь самопроизвольный процесс (из нагревателя в холодильник) перехода тепла идет с возрастанием энтропии. Тогда Q 2/ Q 1 ≥ Т 2/ Т 1, и используя оапределение КПД (2.32), находим, что
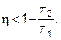 (2.34)
(2.34)
Таким образом, никакими ухищрениями конструкторской мысли нельзя построить тепловую машину с КПД больше, чем КПД идеальной тепловой машины.
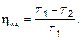 (2.35)
(2.35)
В лучших современных тепловых машинах ηид ≤ 50 % (газовые турбины). Это дорогие устройства, ведь нужно использовать материалы, выдерживающие высокие температуры Т 1. Холодильником практически всех тепловых маленьких машин является атмосфера, а больших — вода (озеро!). Они и загрязняются. Коэффициент полезного действия обычных (автомобильных!) двигателей около 20%.
Всем известно, что нельзя построить вечный двигатель — двигатель, который нарушал бы закон сохранения энергии — первое начало термодинамики. Второе начало запрещает построение двигателя, который бы использовал энергию из источника с меньшей температурой, чем температура, при которой энергия потребляется. И этого действительно сделать нельзя. Например, получить энергию (из океана!) можно, но при этом нужно израсходовать энергии гораздо больше, чем получится в результате. А кому это нужно? Кому выгодно?
Date: 2015-05-08; view: 791; Нарушение авторских прав