
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основное уравнение молекулярно-кинетической теории. Как было установлено, основной характеристикой внутреннего состояния любых систем (твердых, жидких или газообразных)
|
|
Как было установлено, основной характеристикой внутреннего состояния любых систем (твердых, жидких или газообразных), состоящих из достаточно большого числа частиц-молекул, является температура. Такие системы, основной характеристикой внутреннего состояния которых является температура, называются термодинамическими. С другой стороны, простейшей (не равной нулю) характеристикой молекулярного движения является средний квадрат скорости 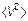 .
.
Более привычной величиной, содержащей эту характеристику, является средняя кинетическая энергия молекулы или просто кинетическая энергия.
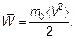 (1.34)
(1.34)
Очевидно, что m 0 — масса одной молекулы.
Разумно предположить, что температура и средняя энергия молекулярного движения — внутренняя энергия, приходящаяся на одну молекулу, должны быть связаны между собой.
Эта связь 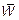 и Т имеет самый простой — простейший вид. Оказывается, что средняя энергия хаотического движения молекул (бывает и направленное — «ветер») газа прямо пропорциональна температуре. Весь дальнейший длинный вывод нужен для определения коэффициента пропорциональности. Попутно, однако, выявляется много нового. Итак, в путь!
и Т имеет самый простой — простейший вид. Оказывается, что средняя энергия хаотического движения молекул (бывает и направленное — «ветер») газа прямо пропорциональна температуре. Весь дальнейший длинный вывод нужен для определения коэффициента пропорциональности. Попутно, однако, выявляется много нового. Итак, в путь!
Чтобы установить эту связь, вспомним, что температура связана с другими характеристиками газа уравнением состояния или
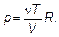 (1.35)
(1.35)
Параметры: р — давление, V — объем, ν — количество вещества (в молях), наряду с температурой, являются характеристиками газа в целом.
Такие характеристики называются макроскопическими — «большими». С другой стороны, такие величины, как масса одной молекулы т 0; скорость 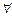 (Vx; Vу; Vz), следовательно, квадрат скорости V 2, являются характеристикой одной молекулы, и их, естественно, называют микроскопическими. Выпишем:
(Vx; Vу; Vz), следовательно, квадрат скорости V 2, являются характеристикой одной молекулы, и их, естественно, называют микроскопическими. Выпишем:
макроскопические характеристики 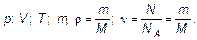
| микроскопические характеристики
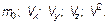
| |
| Давление, объем, температура, масса газа, плотность и количество вещества, равное общему числу молекул, отнесенному к числу Авогадро (или равное массе газа, отнесенной к молярной массе). | Масса молекулы, три проекции скорости на оси координат и образованный из них квадрат скорости
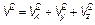 . .
|
Оказывается, что легче всего связать с микроскопическими характеристиками давление. С одной стороны, давление р = F / S, т. е. сила, действующая со стороны газа на единицу площади S поверхности стенок сосуда, окружающего газ. С другой стороны, очевидно, что сила действия газа на стенку возникает из-за ударов молекул (рис. 1.14).
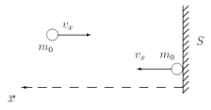
Рис. 1.14. Удар молекулы о стенку, перпендикулярно направленную ее движению
Найти: р —? Дано: m 0; V 2; N; V.
Date: 2015-05-08; view: 782; Нарушение авторских прав