
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Нефелометриялық әдіс
|
|
Нефелометрия – коллоидты бөлшектерге түскен жарық сәулесі шашырауының интенсивтілігін салыстыру арқылы, олардың концентрациясын, бөлшек радиусын анықтауғаарналған әдіс.
4.64 теңдігі бойынша:
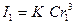 ,
, 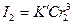 ,
,
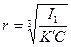 ,
, 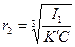 .
.
Бұл өрнектерден мына теңдеудің орында екені шығады:
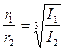 .
.
Золь бөлшектерінің ірілігі бірдей болып, концентрация жөнінен бөлек болса, онда мына қатынас орынды:
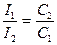
Егер золь концентрациясы әртүрлі болып ерітіндіден шыққан интенсивтілік бірдей болса, онда теңдік төмендегіше жазылады:
I1 = I2 = K'C1I01 = K'C2I02
Бұл теңдіктен төмендегідей қатынас шығады:
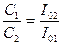
Егер, нефелометрдегі жарық түсірілген биіктіктерді ескеретін болсақ, жоғарғы қатынас былайша түрленеді:
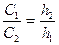
Коллоидты бөлшек радиустарын ескеретін болсақ, бұл теңдік мына түрде жазылады:
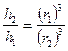
Айтқанымыз түсінікті болу үшін бір мысал қарастыралық.
1 – мысал. Нефелометр көмегімен стандартты және анықталуға тиісті зольдердің жарықты шашырату қабілеті салыстырылады. Стандартты зольдің жарық түсу биіктігі 21 мм, ал анықталуға тиіс зольдікі 5 мм болғанда шашыраған жарықтар интенсивтілігі теңесті. Стандартты зольдің бөлшектерінің орташа радиусы 120 нм. Анықталуға тиісті зольдің бөлшектерінің радиус шамасы қандай?
Талдау. Есеп шарты бойынша:
I1 = I2 = K'C1I01 = K'C2I02
Демек, 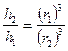 теңдігін пайдаланамыз.
теңдігін пайдаланамыз.
Есептің берілгенін жазып алалық.
Берілгені: Шешімі:
I1 = I2 Формуланы пайдаланамыз.
hст = 21 нм 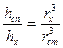 ,
, 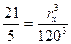 ,
,
hх = 5 мм
r = 120 нм 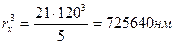 .
.
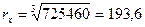
rзоль -?
Нефелометрия әдісін жоғары молекулалық қосылыстардың молярлы массаларын анықтауда пайдалануға болады. Ол үшін мына формула қолданылады: 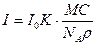 .Мұндағы: К – 4.61 – теңдігіндегі мүшелік; М – жоғары молекулалы заттың молярлы массасы;
.Мұндағы: К – 4.61 – теңдігіндегі мүшелік; М – жоғары молекулалы заттың молярлы массасы;
Мысал. 1 -есеп. Қабырғасы 1 см болатын кубты коллоидты өлшемдегі бөлшекке дейін ұнтаған және оның қабырғасы 10 см теңелді. Осы кубтың әуелгі беттік ауданын ұнталғаннан кейінгі кіші куб санын және олардың қосынды беттік ауданын есептеңдер.
Шешуі. Әуелі берілген қабырғасы 1 см болатын кубтың беттік ауданы 6 см2, өйткені оның әр беті 1 см2, алты жағы алты шаршы см. Оны коллоидты бөлшекке дейін кіші куб түрінде бөлшектегендегі саны 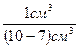 =1021, өйткені ондағы әрбір кіші кубтың қабырғасы 10-7 см, ал әрбір кіші кубтың беткі ауданы 6*(10-7)2 =6* 103 м2.
=1021, өйткені ондағы әрбір кіші кубтың қабырғасы 10-7 см, ал әрбір кіші кубтың беткі ауданы 6*(10-7)2 =6* 103 м2.
2-есеп. Этилацетат ерітіндісінде алюминий золі-коллоид бөлшегі алынады. Осындағы алюминий бөлшегінің 2∙103 В\М потенциал градинті-айырымы кезіндегі потенциалы 42 мВ. Дисперстік ортаэтилацетат қасиеті мынадай қасиеттермен сипатталады: салыстырмалы диэлектрлік өтімділік-6, ал тұтқырлық 0,43 Мн с/м2 тең. Осы коллоид ерітіндісіндегі алюминий бөлшегінің электрофоретті жылдамдығын есептеңдер.
Шешуі. Дзетта-потенциалды есептейтін теңдеуден, коллоид бөлшектің жылдамдығы:
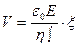
мұндағы 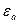 -диэлектрлік абсолют өтімділік және ол салыстырмалы диэлектрлік өтімділіктің вакуумдағы диэлектрлік өтімділікке көбейткенге тең, яғни
-диэлектрлік абсолют өтімділік және ол салыстырмалы диэлектрлік өтімділіктің вакуумдағы диэлектрлік өтімділікке көбейткенге тең, яғни 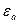 =8,85*10-12*6 ф\м. Ал алюминий золінің бөлшегін допша түрінде деп қабылдаса, ƒ=2\3 тең болады. Бұдан
=8,85*10-12*6 ф\м. Ал алюминий золінің бөлшегін допша түрінде деп қабылдаса, ƒ=2\3 тең болады. Бұдан
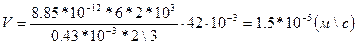
3-есеп. Мышьяк қышқылы мен күкіртті сутек әрекеттескенде, коллоид ерітіндісі алынады:
2H3AsO3 + 3H2S = As2S3 + 6H2O
Осы реакцияда күкіртті сутек шамалы артық болған жағдайдағы золь бөлшегі қандай электродқа қарай бағытталалы?
Шешуі. Ол үшін мицелла жазамыз:
{[(As2S3)m∙nSH-] ∙xH+}- (n-x)H+
мұндағы негізгі бөлшек теріс зарядталған, демек ол анодқа қарай бағыттала жылжиды.
4-есеп. Ағын судың 1,0∙10-2 м3 мөлшеріндегі күміс иодидінің гидрозолін ұйыту үшін, тығыздығы 1,07∙103 кг\м3 болатын 10% натрий хлориді ерітіндісінің 8,0*10-4 м3 көлем қажет. Енді осындай ағын судың 100 м3 көлеміндеболатын күміс иодидін бөліп алу үшін, тығыздығы 1,30*103 кг\м3, 28%-ті алюминий сульфаты ерітіндісінің қандай көлемі керек екенін анықтаңдар. Бұл судағы күміс иодидінің коллоид бөлшегі оң және теріс зарядталған деп қабылдау қажет.
Шешуі: Әуелі 10% натрий хлориді ерітіндісіндегі таза ас тұзын n1-белгілеп есептейді.
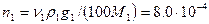 ·1,07·103·10/ (100·0,0585)=1,46 моль
·1,07·103·10/ (100·0,0585)=1,46 моль
мұндағы 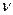 1,
1, 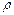 1 және g1- көлем (м3), тығыздық (кг/м3) және ерітіндідегі ас тұзының концентрациясы (%); М1-ас тұзының молярлы массасы (кг/ моль).
1 және g1- көлем (м3), тығыздық (кг/м3) және ерітіндідегі ас тұзының концентрациясы (%); М1-ас тұзының молярлы массасы (кг/ моль).
Бұдан ағын судың натрий хлориді бойынша ұю табалдырығын 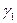 анықтайды:
анықтайды:
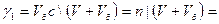 1,46/ (1,0∙10-2+8,0∙10-4)=135 моль/ м3
1,46/ (1,0∙10-2+8,0∙10-4)=135 моль/ м3
Егер коллоидты бөлшектің электрлік заряды оң болса, онда Al2(SO)3 ұйытушы ион қызметін SO42- (z=2) ионы атқарады. Мұндай жағдайдағы осы ион бойынша ұю табалдырығын γ2 табады:
γ2=γ 1/26=135: 64=2,12 моль/м3.
Демек, ағын 100м3 суды ұйыту үшін n2=2,12·100=212 моль сульфат анионы керек. Мұндай сульфат ионы болатын алюминий сульфатының массасы m2 тең:
m2=n2 M2 /3=212·0,342/3=24,2 кг
мұндағы М2-алюминий сульфатының молярлық массасы; 3-молекуладағы SO42- иондарының саны.
Тұздың массасы болатын Al2 (SO4)3 ерітінді көлемі,
V 2=m2·100/g2 ρ2=24,2·100/(28·1,30·103)=6,65·10-2м3,
Мұндағы g2 мен ρ2- Al2(SO4)3 –ерітіндісіндегі концентрация (%) мен тығыздық (кг/м3).
ә.Егер коллоидты бөлшектің электрлік заряды теріс болса, онда алюминий сульфатындағы ұйытушы ион міндеттін алюминий ионы (Al3+, z=3) атқарады. Енді алюминий ионы бойынша жүретін ұю табалдырығын табады:
γ3=γ1/36=135:729=0,186 моль/м3
мұндай жағдайда ағын суды ұйытуғға қажетті алюминий ионы Al3+, тең: n3=0,186·100=18,6 моль. Алюминийдің осындай мөлшердегі ионы болатын алюминий сульфатының массасы m3 тең:
m3=n3 M3 /2=18,6·1,342÷2=3,18 кг
мұндағы 2-Al2 (SO4)3 молекуласындағы алюминий ионының саны.
Құрамында тұздың мұндай массасы болатын Al2 (SO4)3 ерітінді көлемі, тең:
V3=m3·100/(g2 ρ2)=3,18·100/(28·1,30·103)=8,74·10-3м3
5-есеп. Берілген 1м3 көлемде 3,2∙1014 тең бөлшек-түйір болатын күміс иодиді золінің жартылай ұю мерзімі 11,5 с. Ұю жылдамдығының тұрақтысын анықтыңдар.
Шешуі. Есептеуді ұюдың жартылай мерзімін, ұю жылдамдығы тұрақтысымен байланыстыратын формуланы пайдаланып жүргізеді:
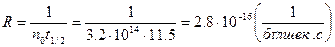
6-есеп. Күміс иодиді золі, мына реакция бойынша алынады:
KI + AgNO3 → AgI + KNO3
KI артық болғанда, калий сульфаты мен кальций ацетаты ерітінділерімен ұйытылады. Қайсы электролиттің ұйытушы әсері басым?
Шешуі. Мұндай золь мицелласының құрылысы:
{[`m(AgI) ∙nI-]xK+}(n-x)K+
Калий катионы диффузиялық қабатты құрайды, яғни қарсы иондар. Ендеше иондардың, ұйытушы әсерін салыстырғанда, енгізетін катион зарядтарын құрастыру қажет. Кальций катионының заряды калийдікінен жоғары болғандықтан, Шульц-Гарди ережесі бойынша кальций ацетатының ұйытушы әсері басым болады.
7-есеп. Гидрозоль бөлшегінің радиусы r=50 мм, тмпература 293К, орта тұтқырлығы η=10-3 Па.с. он секунд мерзіміндегі осы гидрозоль бөлшегінің орташа квадратты ығысуын ∆ және диффузия коэффициентін Д анықтаңдар.
Шешуі. Эйнштейн-Смохуловский теңдеуі:
∆-2=2Дτ
Мұндағы диффузия коэффициенті Эйнштейн теңдеуі бойынша есептеледі:
Д 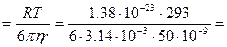 4,29·10-12 м2/с.
4,29·10-12 м2/с.
Бөлшектің орташа квадратты ығысуы:
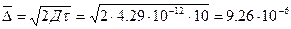 м=9,26 мкм.
м=9,26 мкм.
8-есеп. Хлороформдағы синтетикалық каучук үшін теңдеудің тұрақтысы:
α= 0,56; К=1,85·10-6
Берілген заттың молекулалық массасы 3·105 тең. Осындағы сипаттамалық тұтқырлықты анықтаңдар.
Шешуі. Есептеуге қажетті теңдеу:
[η]= 1,85·10-5 м0,56
[η] = 1,85·10-5 (3·105)0,56=0,0211
9-есеп. Синтетикалық каучук толуолда ерітілген. Осы ерітіндінің сипаттамалық тұтқырлығы 4,62·10-3 м3/моль тең, температурасы 20°С, К=5,14·10-5моль/м3 және α=0,67. Каучуктің молекулалық массасын есептеңдер.
Шешуі. Ол үшін белгілі теңдеуді қолданады:
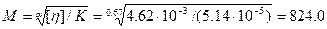 кг/моль
кг/моль
10-есеп. Полистиролды бензолда ерітіп, осы ерітіндінің осмос қысымын 25°С өлшейді. Ол мынадай:
| С, кг/м3 | 1,660 | 4,170 | 6,570 | 9,180 | 11,38 | 13,36 |
| π, Па | 46,3 | 120,9 | 197,8 | 287,3 | 374,0 | 465,0 |
Осындағы осмос қысымының π концентрациядағы С тәуелділігін есептеңдер.
Шешуі. Берілген концентрацияларға тәуелді болатын π/С қатынасын есептейді:
| С, кг/м3 | 1,660 | 4,170 | 6,570 | 9,180 | 11,38 | 13,36 |
| π/С, (Па·м3) | 27,9 | 29,0 | 30,1 | 31,3 | 32,9 | 34,8 |
Жоғарыдағы мәлімет бойынша π/С = ƒ(С) тәуелділігі сызбасын тұрғызады. Сызбадағы орташа нүктелерді түзу арқылы қосып, сосын ордипат осімен қиылысқанша жалғастырып, RT/M қатынасын табады және ол 27,1 (Па·м3)/кг тең. Бұдан:
M=RT/(π/C)= 3.314·298/27.1= 91.4 кг/моль
Мұндағы (π/С)0-ординаттағы түзумен қиылысқан биіктік.
Бұл есепті ПМК көмегімен де шешуге болады.
Бағдарлама. Полимер молекулалық массасының осмометриясы:
| П1 | П7 | П2 | П3 | П4 | П5 | ИП7 | ИП1 | - | |
| + | С/П | П6 | ИП2 | + | П2 | ИП6 | ҒХ2 | ИП3 | |
| + | П3 | С/П | П8 | ИП5 | + | П5 | ИП8 | ИП6 | + |
| ИП4 | + | П4 | FLI | ИП3 | Х | ИП2 | ИП5 | Х | |
| - | ИП3 | ИП7 | Х | ИП2 | ҒХ2 | - | --- | ИПО | ИПА |
| Х | ХУ | ПВ | С/П |
Ереже нұсқау
| Әрекет реті | Енгізетін шама | Батырманы басу реті | Көрінетін сан | |
| басында | соңында | |||
| 8,314 | “8.314” теру, П мен 0 басу | “8,314” | “8,314” | |
| Т | “T” теру, П мен · басу | “T” | “T” | |
| N | “N” теру, В/О мен С/П басу | “N” | “1” | |
| 41 | C1 | “C1” теру, С/П басу | “C” | “B” |
| 51 | π1 | “π1” теру, С/П теру | “π1” | “2” |
4 және 5 баптарға қайта оралады да дисплейде көрінетін і=2,і=3 және т.б сәйкес болатын С1 және π2 мәнін мәшинеге енгізеді. Нәтижені шығару-алу (πн мәнін енгізген соң); V=PX=PV.
Қарастырған мысалдан алынды:
| Әрекет реті | Енгізетін шама | Батырманы басу реті | Көрінетін сан | |
| басында | соңында | |||
| 8,314 | “8,314” теріп, П мен 0 басу | “8,314” | “8,314” | |
| “298” теріп, П мен · басу | “298” | “298” | ||
| “6” | “6” теріп, В/О мен С/П басу | “6” | “1” | |
| 41 | 1,660 | “1,66” теріп, С/П басу | “1,66” | “2,7556” |
| 51 | 46,3 | “46,3” теріп, С/П басу | “46,3” | “2” |
| 46 | 13,36 | “13,36” теріп, С/П басу | “13,36” | “455,5758” |
| 56 | 465,0 | “465” теріп, С/П басу | “465” | “93,129025” |
Мұнан дөңгелектегенде алатыны: М= 93,13 кг/моль, бұл тәжірибе кезінде есептегеннен аса алшақ емес.
Date: 2015-05-08; view: 2490; Нарушение авторских прав