
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Буферные растворы. Буферная емкость. Буферные системы в организме человека, их роль в поддержании гомеостаза рН. Буферные системы крови
|
|
Буферная ёмкость.
Буферной ёмкостью (В) называют кол-во молей эквивалента сильной к-ты или сильного осн-я, которое необходимо добавить к 1-му литру буферного р-ра, чтобы изменить значение его рН на единицу.
Вк-буферная ёмкост в ммоль/л.
Вк=С(1/Z к-ты)*V(к-ты)/V(буферного р-ра) дельта рН.
Буферные системы в организме человека, их роль в поддержании гомеостаза рН. Буферные системы крови.
Для обеспечения стационарного состояния у всех организмов – от морфологически самых простых до наиболее сложных – выработались разнообразные анатомические, физиологические и поведенческие приспособления, служащие одной цели – сохранению постоянства внутренней среды.
Это относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций (кровообращения, дыхания, терморегуляции, обмена веществ и т.д.) организма человека и животных называется гомеостазом.
Этот процесс осуществляется преимущественно деятельностью лёгких и почек за счёт дыхательной и выделительной функции. В основе гомеостаза лежит сохранение кислотно-основного баланса.
При метаболизме в клетках образуются различные кислоты. Большинство из них затем выделяется клетками в виде углекислого газа, который при помощи фермента карбоангидразы связывается в эритроцитах с гемоглобином и переносится в лёгкие. В лёгких углекислый газ замещается кислородом и удаляется при дыхании в окружающую среду. В обычных условиях в организме существует постоянный баланс между образующимся и выдыхаемым углекислым газом, и поэтому накопления кислот в тканях не происходит.
В организме одновременно существует несколько различных буферных систем. В функциональном плане их можно разделить на бикарбонатную и небикарбонатную. Небикарбонатная буферная система включает гемоглобин, различные белки и фосфаты. Она наиболее активно действует в крови и внутри клеток.Бикарбонат является ключевым компонентом главной буферной системы организма. Она состоит из двух кислотно-основных частей, находящихся в динамическом равновесии: угольная кислота / бикарбонатный ион и бикарбонатный ион / карбонатный ион.
Концентрация водородных ионов в крови, которая определяется как рН крови, является одним из параметров гомеостаза, колебания в норме возможны в очень узких пределах от 7,35 до 7,45. Стоит отметить, что смещение рН за указанные пределы приводит к развитию ацидоза (смещение в кислую сторону) или алколоза (в щелочную сторону). Организм способен сохранять жизнедеятельность, если рН крови не выходит за пределы 7,0-7,8. В отличие от крови, параметры кислотно-основного состояния для различных органов и тканей колеблются в более широких пределах. Например, рН желудочного сока составляет в норме 2,0, простаты – 4,5, а в остеобластах среда щелочная, и значение рН достигает отметки в 8,5.
Регуляция кислотно-основного состояния в крови осуществляется за счет специальных буферных систем, которые реагируют на изменение рН достаточно быстро, посредством дыхательной системы и почек, а также пищеварительного канала и кожи, через которые выводятся кислые и щелочные продукты. Для изменения рН крови легким потребуется около 1-3 минут (за счет уменьшения или увеличения частоты дыхания и выведения углекислого газа), а почкам – около 10-20 часов.
Таким образом, буферные системы крови являются наиболее быстро реагирующим механизмом регуляции рН крови. К буферным системам относят белки плазмы крови, гемоглобиновый, бикарбонатный и фосфатный буферы.
13.Основные понятия термодинамики: термодинамическая система, термодинамические параметры, функции состояния. Классификация термодинамических систем.Понятия о внутренней энергии и энтальпии. Первый закон термодинамики. Классификация термодинамических процессов.
Термодинамическая система — это процесс или среда, которая используется при анализе передачи энергии.
Системы, которые обмениваются с окружающей средой, вещ-ом и энергией называются открытыми. Если обмен только энергией-закрытая система.
Изолированная система-не обменивается не с окружающей средой, не с обменом и энергией.
Температура и давленияе и объём являются параметрами системы. Они являются функцией состояние системы.
Любая ТДС характеризуется параметрами: температура, давление, плотность, концентрация, мольный объем. В любой ТДС обязательно протекают процессы, и они могут быть равновесными, неравновесными, обратимыми и необратимыми.
Если в ТДС определенное свойство системы не будет изменяться во времени, т. е. оно будет одинаковым во всех точках объема, то такие процессы – равновесные.
В неравновесных процессах свойство системы будет изменяться во времени без воздействия окружающей среды.
Обратимые процессы – процессы, в которых система возвращается в первоначальное состояние.
Необратимые – когда система не возвращается в первоначальное состояние.
Функции могут зависеть от пути процесса. Функции, которые зависят от начального и конечного состояний системы и не зависят от пути процесса, – функции состояния; внутренняя энергия, энтальпия, энтропия и другие – полные дифференциалы.
Функции, которые зависят от начального и конечного состояний системы и зависят от пути процесса, не являются функциями состояния и не являются полными дифференциалами Q, A.
Понятия о внутренней энергии и энтальпии. Первый закон термодинамики. Классификация термодинамических процессов.
Внутренняя энергия (система тел) U– это энергия движения и взаимодействия частиц, из которых состоит тело.
Энтальпия(нагреваю) — это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту. дельта H. Изменение энтальпии характеризует изабарный процесс-постоянное давление.
Классификация термодинамических процессов.
Эндо- и экзотермические процессы.
Эндотермические процессы сопровождаются поглощением энергии системой из окружающей среды.
Экзотермические процессы сопровождаются выделением энергии из системы в окружающую среду.
Тепловые эффекты химических реакций. Первый закон Гесса и следствия из него. Термодинамические расчеты для энергетической характеристики биохимических процессов и оценки калорийности продуктов питания.
Закон Гесса: тепловой эфект реакции не зависит от пути прохождения реакции, а только от начального и конечного состояния.
1-ое следствие из закона Гесса: тепловой эффект прямой реакции равен тепловому эфект обратной реакции с обратным знаком.
2-ое следствие-тесловой эффект циклического процесса равен нулю.
3-ое следствие-тепловой эффект реакции равен разности между суммой энтальпии продуктов и сумме энтальпии исходных вещ-в.
аА+вВ→ сС+dD+Q
Любой самопроизвольный процесс протекает с уменьшением энергии системы. Теплота не может самопроизвольно переходить от менее нагретого тела, к более нагретому.
Второй закон термодинамики. Понятие энтропии. Энтропия как мера неупорядоченности вселенной. Термодинамические потенциалы. Энергия Гиббса, энергия Гельмгольца. Критерии направленности процессов.Экзэргонические и эндэргонические процессы.
Второй закон термодинамики: все самопроизвольные процессы в природе идут с увеличением энтропии. (Энтропия - мера хаотичности, неупорядоченности системы).
Энтропия, или S-термодинамическая функция состояние системы, которая является мерой упорядочености системы. Стандартная энтропия для простых в-в не равна нулю. Зависит от природы в-ва, от агрегатного состояния в-ва, от температуры (с ростом, которой энтропия возрастает).
Термодинамическими потенциалами, или характеристическими функциями, называют термодинамические функции, которые содержат в себе всю термодинамическую информацию о системе. Наибольшее значение имеют четыре основных термодинамических потенциала: 1) внутренняя энергия U(S,V), 2) энтальпия H(S,p) = U + pV, 3) энергия Гельмгольца F(T,V) = U - TS, 4) энергия Гиббса G(T,p) = H - TS = F + pV.
Самопроизвольно протекающие при данных условиях реакции называются экзергоническими; реакции, которые могут протекать только при оказании постоянного воздействия извне называютсяэндергоническими.
Направление химической реакции определяется значением ΔG. Если эта величина отрицательна, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии. Такие реакции называютэкзергоническими. Если при этом абсолютное значение ΔG велико, то реакция идёт практически до конца, и её можно рассматривать как необратимую.
Если ΔG положительно, то реакция будет протекать только при поступлении свободной энергии извне; такие реакции называют эндергоническими
Основные понятия химической кинетики. Скорость химической реакции, факторы ее определяющие. Константа скорости химической реакции. Понятие о порядке реакции. Кинетические уравнения реакций нулевого, первого и второго порядков.
Химическая кинетика-это раздел химии, который изучает механизмы и скорости протекания химических реакций.
Процессы протекающие быстро называются лабильными.
Процессы протекающие медленно называются инертными.
Факторы, которые влияют на скорость гомогенной реакции (все реагенты находятся в 1-ой фазе, напр. в растворе): 1)природа реагентов; 2) концентрация реагентов; 3)температура;4)катализатор. Введение катализатора в системе приводит к снижению энергии активации. Всё это гомогенные реакции.
Факторы влияющие на скорость гетерогенной реакции (реагенты находящиеся в разных фазах, напр. ж. и тв.): 1)природа реагирующих в-в; 2)температура; 3)скорость диффузий молекул; 4)величина поверхности раздела фаз; 5)катализатор.
Кинетические уравнения. Константа скорости химической реакции. Понятие о порядке реакции. Кинетические уравнения реакций нулевого, первого и второго порядков.
Уравнение Аррениуса: К=А*е-Е/(RT), где А-постоянная, не зависящая от температуры, е=2,71828, Е-энергия активации, R=8,314 Дж(К*моль)-газовая постоянная.
Константа скорости увеличивается с увеличение температуры и уменьшением энергии активации.

Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
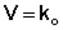
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
Date: 2015-11-13; view: 1185; Нарушение авторских прав