
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Понятие о гальванических элементах
|
|
Возникновение э. д. с. в гальваническом элементе. Простейший медно-цинковый гальванический элемент Вольта (рис. 156) состоит из двух пластин (электродов): цинковой 2 (катода) и медной 1 (анода), опущенных в электролит 3, представляющий собой водный раствор серной кислоты H2SO4. При растворении серной кислоты в воде происходит процесс электролитической диссоциации, т. е. часть молекул кислоты распадается на положительные 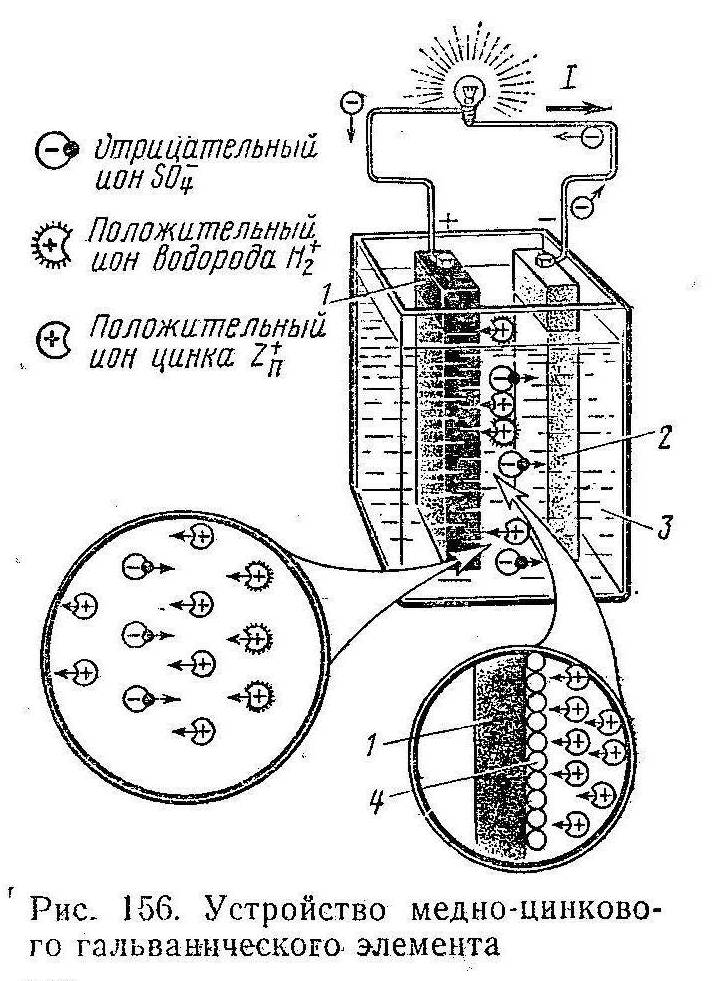 ионы водорода Н2+ отрицательные ионы кислотного остатка SO4-. Одновременно происходит растворение цинкового электрода в серной кислоте. При растворении этого электрода положительные ионы цинка Zn+ переходят в раствор и соединяются с отрицательными ионами SO4- кислотного остатка, образуя нейтральные молекулы сернокислого цинка ZnSO4. При этом на цинковом электроде будут скапливаться оставшиеся свободные электроны, вследствие чего этот электрод приобретает отрицательный заряд. В электролите же образуется положительный заряд ввиду нейтрализации части отрицательных ионов SO4-. Таким образом, в пограничном слое между цинковым электродом и электролитом возникает некоторая разность потенциалов и создается электрическое поле, которое препятствует дальнейшему переходу положительных ионов цинка в электролит; при этом растворение цинкового электрода прекращается. Медный электрод практически не растворяется в электролите и приобретает тот же положительный потенциал, что и электролит. Разность потенциалов медного φCu и цинкового φZn электродов при разомкнутой внешней цепи представляет собой э. д. с. Е рассматриваемого гальванического элемента Е = φCu — φZn.
ионы водорода Н2+ отрицательные ионы кислотного остатка SO4-. Одновременно происходит растворение цинкового электрода в серной кислоте. При растворении этого электрода положительные ионы цинка Zn+ переходят в раствор и соединяются с отрицательными ионами SO4- кислотного остатка, образуя нейтральные молекулы сернокислого цинка ZnSO4. При этом на цинковом электроде будут скапливаться оставшиеся свободные электроны, вследствие чего этот электрод приобретает отрицательный заряд. В электролите же образуется положительный заряд ввиду нейтрализации части отрицательных ионов SO4-. Таким образом, в пограничном слое между цинковым электродом и электролитом возникает некоторая разность потенциалов и создается электрическое поле, которое препятствует дальнейшему переходу положительных ионов цинка в электролит; при этом растворение цинкового электрода прекращается. Медный электрод практически не растворяется в электролите и приобретает тот же положительный потенциал, что и электролит. Разность потенциалов медного φCu и цинкового φZn электродов при разомкнутой внешней цепи представляет собой э. д. с. Е рассматриваемого гальванического элемента Е = φCu — φZn.
Э. д. с. создаваемая гальваническим элементом, зависит от химических свойств электролита и металлов, из которых выполнены электроды. Обычно подбирают такие комбинации металлов и электролита, при которых э. д. с. имеет наибольшее значение; однако почти во всех применяемых элементах она не превышает 1,1—1,5 В.
При подключении к электродам гальванического элемента какого-либо приемника электрической энергии (см. рис. 156) по внешней цепи начнет протекать ток I от медного электрода (положительный полюс элемента) к цинковому (отрицательный полюс). В электролите в это время начнется движение положительных ионов цинка Zn+ и водорода Н2+ от цинковой пластины к медной и отрицательных ионов кислотного остатка SO4- от медной пластины к цинковой. В результате нарушится равновесие электрических зарядов между электродами и электролитом, вследствие чего в электролит с катода снова начнут поступать положительные ионы цинка, поддерживая на этом электроде отрицательный заряд; на медном же электроде будут осаждаться новые положительные ионы. Таким образом, между анодом и катодом все время будет существовать разность потенциалов, необходимая для прохождения тока по электрической цепи.
Поляризация. Рассмотренный гальванический элемент Вольта не может длительно работать вследствие возникающего в нем вредного явления поляризации. Сущность этого явления заключается в следующем. Положительные ионы водорода Н2+, направляющиеся к медному электроду 1, взаимодействуют с имеющимися на нем свободными электронами и превращаются в нейтральные атомы водорода. Эти атомы покрывают поверхность медного электрода сплошным слоем 4, что ухудшает работу гальванического элемента по двум причинам. Во-первых, между слоем водорода и электролитом возникает дополнительная э. д. с. (э. д. с. поляризации), направленная против основной э. д. с. элемента, поэтому его результирующая э. д. с. Е уменьшается. Во-вторых, слой водорода отделяет медный электрод от электролита и препятствует подходу к нему новых положительных ионов. При этом резко возрастает внутреннее сопротивление гальванического элемента.
Для борьбы с поляризацией во всех гальванических элементах вокруг положительного электрода располагают специальные вещества —деполяризаторы, которые легко вступают в химическую реакцию с водородом. Они поглощают подходящие к положительному электроду ионы водорода, не позволяя им осаждаться на этом электроде.
 В настоящее время промышленность выпускает гальванические элементы различных типов (с различными электродами и электролитами), имеющие разное, конструктивное выполнение. Наиболее распространены угольно-цинковые элементы, в которых угольный и цинковый электроды погружены в водный раствор хлористого аммония (нашатыря) или поваренной соли, а в качестве деполяризатора применяется перекись марганца.
В настоящее время промышленность выпускает гальванические элементы различных типов (с различными электродами и электролитами), имеющие разное, конструктивное выполнение. Наиболее распространены угольно-цинковые элементы, в которых угольный и цинковый электроды погружены в водный раствор хлористого аммония (нашатыря) или поваренной соли, а в качестве деполяризатора применяется перекись марганца.
Сухие элементы. Разновидностью гальванического элемента является сухой элемент (рис. 157), применяемый в батареях карманных электрофонарей, радиоприемниках и пр. В этом элементе жидкий электролит заменен тестообразной массой, состоящей из раствора нашатыря. смешанного с древесными опилками и крахмалом, а цинковый электрод выполнен в виде цилиндрической коробки, используемой в качестве сосуда, в котором помещают электролит и угольный электрод. Для отвода газов, образующихся при работе элемента, в нем предусматривают газоотводную трубку.
Емкость. Способность химических источников тока отдавать электрическую энергию характеризуется их емкостью. Под емкостью понимают количество электричества, запасенного в гальванических элементах или аккумуляторах. Емкость измеряется в ампер-часах. Номинальная емкость химического источника тока равна произведению номинального (расчетного) разрядного тока (в амперах), отдаваемого химическим источником тока при подключении к нему нагрузки, на время (в часах) до того момента, пока его э. д. с. не достигнет минимально допустимого значения. При длительной работе количество электроэнергии, которое может отдать гальванический элемент, уменьшается, так как постепенно расходуются имеющиеся в нем активные химические вещества, обеспечивающие возникновение э. д. с.; при этом уменьшаются э. д. с. элемента и его емкость и возрастает его внутреннее сопротивление.
Гальванический элемент обладает номинальной емкостью только в том случае, если после его изготовления прошло сравнительно небольшое время. Емкость гальванического элемента постепенно уменьшается, даже если он не отдает электрической энергии (после 10—12 месяцев хранения емкость сухих элементов уменьшается на 20—30%). Это объясняется тем, что химические реакции в таких элементах протекают непрерывно и запасенные в них активные химические вещества все время расходуются.
Уменьшение емкости химических источников, тока с течением времени называется саморазрядом. Емкость гальванического элемента снижается также при разряде его большим током.
Date: 2015-11-13; view: 937; Нарушение авторских прав