
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическая кинетика и равновесие
|
|
Кинетика — учение о скорости различных процессов, в том числе химических реакций. Критерием принципиальной осуществимости реакций является неравенство ∆Gp,Т < 0. Но это неравенство не является полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Скорость химических реакций зависит от многих факторов, основные из которых - |концентрация (давление) реагентов, температура и действие катализатора. Эти же факторы определяют и достижение равновесия в реагирующей системе.
Пример. Константа равновесия гомогенной системы
СО(г) + Н2О(г) ↔ СО2(г) + Н2(г)
при 850° С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх = 3 моль/л,
[Н2О] исх = 2 моль/л.
Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
v np = К1 [CO][H2O]; v o6p = К2 [СО2][Н2];
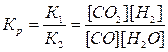
В условии задачи даны исходные концентрации, тогда как в и выражение Крвходят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [СО2]Р = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для празования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ (моль/л):
[СО2]Р = [Н2]р = х; [СО]Р = (3 - х); [Н2О]Р =(2- х).
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:
1= х 2/(3- х)(2- х); х 2 = 6-2 х -3 х + х 2; 5 х =6; х =1,2 моль/л.
Таким образом, искомые равновесные концентрации: [СО2]Р = 1,2 моль/л; [Н2]р = 1,2 моль/л; [СО]Р= 3 — 1,2 = 1,8 моль/л; [Н2О]Р = 2- 1,2 = 0,8 моль/л.
23. Константа скорости реакции A + 2В ↔ 3С равна 0,8. Начальные концентрации веществ А и В равны соответственно 2,0 М и 3,0 М. Вычислите скорость реакции в начальный момент и когда концентрация вещества В стала равной 0,6 М.
24. Константа скорости реакции 2 А + В ↔ 2С равна 0,6. Начальные концентрации веществ А и В равны соответственно 0,4 М и 0,5 М. Вычислите скорость реакции в начальный момент и в момент, когда концентрация вещества А уменьшится на 0,2 М.
25. Через 10 минут после начала реакции 3 А + В ↔ 2 С концентрации веществ A, В и С составили соответственно 0,3 М, 0,1 М и 0,04 М. Константа скорости реакции равна 0,5. Вычислите скорость реакции в начальный момент и через 10 минут после начала реакции.
26. Константа скорости реакции разложения оксида азота (I) на азот и кислород равна 5 х 10 -4. Исходная концентрация оксида азота (I) равна 4,0 М. Вычислите начальную скорость реакции и ее скорость, когда разложится 40% оксида азота (I).
27. В гомогенной системе А + 2 В ↔ С равновесные концентрации веществ А, В и С равны соответственно 0,05 М, 0,10 М и 0,20 М. Вычислите константу равновесия и исходные концентрации веществ А и В.
28. Константа равновесия при синтезе аммиака из азота и водорода, равна 0,1.Равновесные концентрации водорода и аммиака равны соответственно 0,6 М и 0,2 М. Вычислите начальную и равновесную концентрации азота.
29. Концентрации оксида серы (IV) и кислорода до реакции были соответственно равны 0,03 М и 0,015 М. При равновесии концентрация оксида серы (IV) стала равной 0,01 М. Вычислите равновесные концентрации кислорода, оксида серы (VI) и константу равновесия: SO2 +O2 ↔ SO3
30. Равновесие процесса разложения оксида азота (IV) на оксид азота (II) и кислород установилось при концентрациях оксида азота (IV), оксида азота (II) и кислорода, равных соответственно 0,08 М, 0,02 М и 0,01 М. Вычислить константу равновесия и начальные концентрации исходных веществ.
31. Константа равновесия гомогенной системы АВ ↔ А + В равна 0,06. Равновесная концентрация вещества А равна 0,03 М. Найти начальную концентрацию вещества АВ. Какая доля этого вещества разложилась к моменту установления равновесия?
32. Равновесие в системе А + В ↔ 2 АВ установилось при концентрациях веществ А, В и АВ, равных соответственно, 0,04 М, 0,02 М и 0,06 М. Вычислите константу равновесия и начальные концентрации исходных веществ.
33. В гомогенной системе А + В ↔ 2С равновесные концентрации веществ А, В и С равны соответственно 0,12 М, 0,12 М и 0,06 М. Вычислите константу равновесия и начальные концентрации веществ А и В.
Контрольные задания №4
Date: 2015-10-19; view: 1306; Нарушение авторских прав