
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Моль. Эквиваленты. Молярные массы эквивалентов. Закон эквивалентов
|
|
Эквивалентом вещества называется некоторая условная или реальная частица этого вещества, которая соединяется с одним атомом или ионом водорода или замещает его в химических реакциях. Например, в реакции
2HCl + Ca(OH)2 →CaCl2+ 2Н2О
двум атомам водорода в HCl соответствует одна частица Ca(OH)2. Следовательно, одному атому водорода эквивалентна условная частица, равная ½ Ca(OH)2. Это и будет эквивалентом гидроксида кальция. Число ½ носит название фактора эквивалентности, который обозначается символом fэк. В приведенном примере f эк. Ca(OH)2 =½.
Пример. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите молярную массу эквивалента оксида и молярную массу эквивалента металла. Чему равна атомная масса металла?
Нормальные условия по Международной системе единиц (СИ): давление 1,013 х 105 Па (760 мм рт. ст. = 1 атм), температура 273 К или 0°С.
Решение. Согласно закону эквивалентов массы (объемы) реагирующих веществ m1 и m2пропорциональны их молярным массам (объемам):

 (1)
(1)
Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах (см3, л, м3). Объем, занимаемый при данных условиях молярной массой эквивалента газообразного вещества, называется молярным объемомэквивалента этого вещества. Молярный объем любого газа прин.у. равен 22,4 л. Отсюда эквивалентный объем водорода Vэк водорода (Н2), молекула которого состоит из двух атомов, равен 22,4/2 = 11,2 л. В формуле (1) отношение  заменяем равным ему отношением
заменяем равным ему отношением 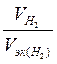 , где — V(H2) объем водорода, Vэк(H2) - эквивалентный объем водорода:
, где — V(H2) объем водорода, Vэк(H2) - эквивалентный объем водорода:
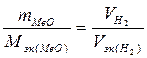 ……(2)
……(2)
Из уравнения (2) находим молярную массу эквивалента оксида металла Мэк (МеО):
 ;
; 

Согласно закону эквивалентов Мэк (МеО) = Мэк (Ме) +Мэк (О2). Отсюда Мэк (Ме) = Мэк (МеО) - Мэк (О2) = 35,45 - 8 = 27,45 г /моль. Молярная масса металлаопределяется из соотношения М (Ме) = Мэк (Ме) / f эк. Ме = 27,45 / ½ = 54,9г/моль. Так как относительная атомная масса в а.е.м. численноравна относительной молярной массе, выражаемой в г/моль,то искомая масса металла рана 54,9 а.е.м. Металл – марганец.
1. При взаимодействии 3,24 г трехвалентного металла с кислотой выделилось 4,02 л водорода (н.у.). Вычислите молярные массы эквивалентов металла, его оксида и атомную массу металла.
2. При восстановлении водородом 10,17 г оксида двухвалентного металла образовалось 2,25 г воды, молярная масса эквивалента которой 9,00 г/моль. Вычислите молярные массы эквивалентов металла, его гидроксида и атомную массу металла.
3. На сжигание 2,99 г двухвалентного металла потребовалось 1,33 л кислорода (н.у.). Вычислите молярные массы эквивалентов металла, его оксида. Какой это металл?
4. При восстановлении 6,50 г оксида трехвалентного металла образовалось 4,45 г металла. Вычислите молярные массы эквивалентов металла, его оксида. Какой это металл?
5. Сульфид мышьяка содержит 39,0% серы, молярная масса эквивалента которой 16,0 г/моль. Вычислите молярную массу эквивалента и валентность, мышьяка, составьте формулу этого вещества.
6. При реакции между 0,366 г двухвалентного металла и кислотой выделилось 336 мл водорода (н.у.). Вычислите молярные массы эквивалентов металла, его оксида и определите какой это металл.
7. Водородное соединение трехвалентного элемента содержит 8,9% водорода. Вычислите молярные массы эквивалентов элемента, данного гидрида и атомную массу элемента.
8. Для растворения 16,86 г металла потребовалось 14,7 г серной кислоты. Вычислите молярные массы эквивалентов металла и его оксида.
9. Двухвалентный металл массой 0,601 г взаимодействует с серой массой 0,480 г. Вычислите молярные массы эквивалентов металла, сульфида металла и атомную массу металла.
10. B оксиде трехвалентного металла массой 5,10 г содержится 2,40 г кислорода. Вычислите молярные массы эквивалентов металла, его оксида и атомную массу металла.
11. При окислении 2,81 г двухвалентного металла образовалось 3,21 г его оксида. Вычислите молярную массу металла. Какой это металл? Какова молярная масса металлаи молярная масса эквивалента металла?
Контрольные задания №2
Date: 2015-10-19; view: 1663; Нарушение авторских прав