
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторные работы. Лаборатоpная работа № 1.Изучение действия ферментов
Лаборатоpная работа № 1. Изучение действия ферментов
Действие липазы.
Липаза входит в состав сока поджелудочной железы. В желудочном соке она содержится в небольшом количестве и действует только на предварительно эмульгированные жиры. В кишечнике желчные кислоты и белки способствуют эмульгированию липидов. Действие липазы можно обнаружить, добавив ее раствор к молоку, предварительно слабо подщелоченному раствором карбоната натрия в присутствии фенолфталеина, дающего бледно-розовую окраску.
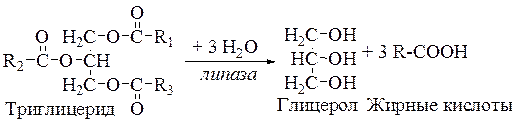
Принцип метода. Липаза ускоряет гидролиз нейтрального жира на глицерин и жирные кислоты (см. уравнение), что приводит к снижению pH и исчезновению розовой окраски индикатора – фенолфталеина.
Ход работы. В две пробирки наливают по 10 капель молока. В 1-ю пробирку добавляют 5 капель панкреатина, содержащего липазу, во 2-ю – 5 капель воды. В обе пробирки наливают по 1 капле 0,5 %-го раствора фенолфталеина и по каплям 1 %-го раствора карбоната натрия до появления бледно-розовой окраски при pH 8,0 (нельзя приливать избыток раствора карбоната натрия). Пробирки помещают в термостат при температуре 38 °С на 30 мин. Наблюдают обесцвечивание раствора в пробирке, содержащей липазу.
Выводы по результатам работы.
______________________________________________________________
______________________________________________________________
______________________________________________________________
Действие уреазы.
Принцип метода. Уреаза катализирует гидролиз мочевины на двуокись углерода и аммиак (см. уравнение), что приводит к увеличению pH, которое регистрируется индикатором – фенолфталеином.

Ход работы. Берут две пробирки. В 1-ю отмеривают 1мл 1 %-го раствора мочевины, а во 2-ю ‑ 1мл 1 %-го раствора тиомочевины. В каждую пробирку добавляют по 2 капли фенолфталеина и по 1 мл раствора уреазы. Содержимое обеих пробирок встряхивают, оставляют на несколько минут при комнатной температуре и наблюдают за появлением розовой окраски в пробирке с мочевиной и отсутствием окраски в пробирке с тиомочевиной. Содержимое 1-й пробирки приобретает розовую окраску вследствие смещения pH раствора в щелочную сторону за счет образования аммиака.
Выводы по результатам работы.
______________________________________________________________
______________________________________________________________
______________________________________________________________
Лаборатоpная работа № 2. Изучение влияния различных факторов на скорость ферментативных реакций (УИРС).
Влияние активаторов и ингибиторов на активность амилазы.
Ход работы.
1 В одну пробирку вносят 10 капель дистиллированной воды, а во 2-ю – 8 капель воды и 2 капли 1 %-го раствора хлорида натрия, в 3-ю – 8 капель воды и 2 капли раствора сульфата меди.
2 В каждую пробирку добавляют по 20 капель разведенной слюны (1: 10), пробирки перемешивают, добавляют по 5 капель раствора крахмала и оставляют стоять при комнатной температуре 5 мин.
3 Тем временем готовят 3 пробирки с водой (по 1 мл), подкрашенной каплей раствора йода, и добавляют в них по 3 капли содержимого опытных проб. Наблюдают окрашивание в зависимости от степени расщепления крахмала амилазой. В 1-й пробирке появляется фиолетовая или красно-бурая окраска, во 2-й пробирке, где ионы хлора играют роль активатора, появляется желтая окраска, а в 3-й, где ионы меди тормозят действие амилазы, – окраска остается синей. Если описанная картина не наблюдается, то опыт повторяют через 10–15 мин.
Выводы по результатам работы.
______________________________________________________________
______________________________________________________________
______________________________________________________________
Влияние pH на активность амилазы слюны.
Оптимум pH для действия амилазы слюны можно определить при взаимодействии ее с крахмалом при различных значениях pH среды. О степени расщепления крахмала можно судить по реакции крахмала с йодом в течение времени. При оптимальном значении pH расщепление крахмала произойдет полностью (окраска с йодом отсутствует). По мере удаления от точки pH в кислую или щелочную сторону произойдет лишь частичное расщепление крахмала до стадии декстринов (красно-бурая или фиолетовая окраска) или крахмал вообще расщепляться не будет (синяя окраска).
Ход работы.
1 В 4 пронумерованные пробирки отмеривают отдельными пипетками по 2 мл фосфатного буфера с различным значением pH (6,0; 6;4, 6,8; 7,4).
2 В каждую пробирку добавляют по 1 мл раствора крахмала и по 0,5 мл разбавленной (1: 10) слюны, которые помещают в термостат на 10 мин при 38 °С.
3 Из каждой пробирки каплю жидкости смешивают с каплей раствора йода на предметном стекле и сравнивают окрашивание в каждой пробирке. Повторяют эту пробу через 1-2 мин до тех пор, пока проба из 5-й пробирки даст с йодом на стекле красно-бурое окрашивание. Через 1-2 мин после этого во все пробирки добавляют по 2-3 капли раствора йода (начинать с 1-й пробирки). Содержимое пробирок хорошо взбалтывают. Сравнивают между собой окрашивание во всех пробирках и делают вывод о степени расщепления крахмала, а, следовательно, об активности фермента при этом значении pH среды.
Выводы по результатам работы.
______________________________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
Рекомендуемая литература
Основная
1 Кухта, В.К и др. Биологическая химия: учебник / В.К. Кухта, Т.С. Морозкина, Э.И. Олецкий, А.Д. Таганович; под ред. А.Д. Тагановича. – Минск: Асар, М.: Издательство БИНОМ, 2008. – С. 57-82.
2 Биохимия: Учебник для вузов / Под ред. Е.С. Северина. – 4-е изд., испр. – М.: ГЭОТАР-Медиа, 2006. – С. 92-118.
3 Филиппович, Ю. Б. Основы биохимии. – 4-е изд. – М.: Агар, 1999. – С. 102-114.
4 Николаев, А.Я. Биологическая химия. М.: Медицинское информационное агентство, 2004. – С. 63-66, 80-97.
5 Марри Р. и др. Биохимия человека: в 2-х т.: Пер. с англ., М.: Мир, 2004. – Т.1: С. 67-68, 76-90, 98-110.
6 Березов, Т. Т. Биологическая химия / Т.Т. Березов, Б.Ф. Коровкин. – М.: Медицина, 1998. – С. 143-156.
Дополнительная
7 Ленинджер, А. Л. Основы биохимии. М.: Мир, 1985. Т. 1. С. 226–302.
8 Албертс Б. и др. Молекулярная биология клетки. М.: Мир, 1994. Т. 1. С. 113–171.
Занятие 5 Дата: _________________
Ферменты-3. Медицинская энзимология
Цель занятия: сформировать представления об основных аспектах и проблемах медицинской энзимологии. Научиться определять активность амилазы в моче и оценивать ее диагностическую значимость.
Date: 2015-10-19; view: 1910; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |