
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гомогенные химические реакции
|
|
Скорость гомогенной химической реакции равна изменению концентрации какого-либо из веществ, вступающих в реакцию или образующихся в результате ее, в единицу времени.
Зависимости концентраций исходных веществ или продуктов реакции от времени называются кинетическими кривыми (рис. 4.1).
В ходе реакции количества исходных веществ во времени убывают, количества продуктов реакции увеличиваются. Скорость является положительной величиной, поэтому перед отношением в правой части уравнения ставят знак «минус», если ее определяют по расходу исходного вещества, и знак «плюс», если ее определяют по увеличению концентрации продукта реакции.
В общем случае
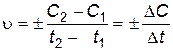 . .
| (4.1) |
Отношение изменения концентрации одного из реагирующих веществ к промежутку времени выражает среднюю скорость реакции
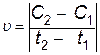 .
.
Из определения скорости и анализа уравнения (4.1) следует, что скорость реакции имеет единицу измерения [моль∙л-1·с-1] (иногда [моль∙м-3·с-1], [моль·л-1·ч-1] и т.п.).
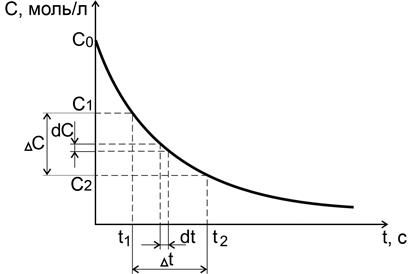
Рис. 4.1. Средняя и истинная скорости реакции для исходного
вещества
В ходе реакции изменяются концентрации реагирующих веществ и соответственно скорость реакции. Средняя скорость реакции тем ближе к истинной скорости, чем меньше промежуток времени D t. За бесконечно малый промежуток времени dt концентрация изменится на бесконечно малое значение dC.
Скорость реакции в данный момент времени, или мгновенная (истинная) скорость реакции, представляет собой первую производную концентрации реагирующего вещества по времени
 . .
| (4.2) |
При описании кинетического процесса необходимо указывать вещество, по отношению к которому была измерена скорость («скорость по веществу»).
Рассмотрим в качестве примера следующую реакцию:
N2 + 3H2 = 2NH3.
Из уравнения реакции видно, что если за какой-то период времени D t в реакцию вступит n молей N2, то за это же время прореагирует 3 n молей Н2 и образуется 2 n молей NH3. Следовательно, скорости реакции по каждому из веществ различны, однако, разделив эти скорости на стехиометрический коэффициент, соответствующий этому веществу в уравнении реакции, получим одну и ту же величину – просто «скорость реакции»
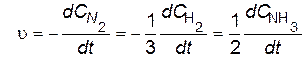 .
.
Date: 2015-10-19; view: 552; Нарушение авторских прав