
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Подготовка к защите лабораторной работы
|
|
1. Изучить материал занятия в литературе [1] и в конспекте лекций.
2. Выучить значения основных терминов и определений.
3. Подготовиться к письменному опросу по терминам и определениям и решению задач.
ПРИЛОЖЕНИЕ А
Основные термины и определения
Адиабатический процесс – процесс перехода изолированной системы из одного состояния в другое при отсутствии обмена теплом (Q=0) с окружающей средой.
Адсорбат – адсорбированное вещество.
Адсорбтив – вещество, которое может адсорбироваться.
Адсорбция – представляет собой процесс поглощения газов, паров или жидкостей поверхностью пористых твердых тел (процесс концентрирования веществ на границе поверхности раздела).
Внутренняя энергия(U) – общий запас энергии, включая движение молекул, колебание связей, движение электронов, ядер и т. д. Это все виды энергии кроме потенциальной и кинетической энергии системы в целом.
Гетерогенные химические реакции – реакции, протекающие на границе раздела фаз.
Гетерогенный катализ – это ускорение химической реакции на границе раздела катализатор – реагирующая система.
Гомогенный катализ – процесс ускорения химических реакций, осуществляется через промежуточные реакции с катлизатором и в результате происходит замена одной реакции с высокой энергией активации несколькими, у которых энергия активации ниже, а скорость выше, протекает в гомогенной среде.
Диффузионный слой – тонкий слой около реакционной поверхности, перенос вещества в котором осуществляется в основном за счет молекулярной диффузии.
Закон действующих масс – скорость химической реакции прямопропорциональна произведению концентраций реагирующих веществ при постоянной температуре.
Закрытые системы – системы, которые обмениваются с окружающей средой только энергией.
Избыток адсорбированного вещества(Г) – количественная мера адсорбции, равен разности концентраций вещества в поверхностном слое и в объеме раствора, моль/м2.
Изобарический процесс – процесс перехода системы из одного состояния в другое при постоянном давлении.
Изобарно-изотермический – процесс перехода термодинамической системы из одного состояния в другое при постоянных давлении и температуре.
Изолированные системы – системы, которые не обмениваются ни веществом, ни энергией с окружающей средой.
Изотерма адсорбции – зависимость адсорбции Г от равновесной концентрации с или равновесного парциального давления р при постоянной температуре.
Изотерма Вант-Гоффа – уравнение, выражающее связь между энергией Гиббса ΔG и концентрациями участвующих в реакциях веществ  .
.
Изотермический процесс – процесс перехода системы из одного состояния в другое при постоянной температуре.
Изохорический процесс – процесс перехода термодинамической системы из одного состояния в другое при постоянном объеме.
Калориметрия – экспериментальное определение тепловых эффектов.
Катализ – явление изменения скорости реакции под действием катализатора.
Катализатор – вещество, которое ускоряет химическую реакцию, но не испытывает в результате химического превращения.
Кинетическое уравнение – зависимость скорости химических реакций от концентрации участвующих веществ.
Колебательные реакции – периодические процессы, характеризующиеся колебаниями концентраций некоторых промежуточных соединений и соответственно скоростей превращения.
Константа скорости химической реакции – численно равна скорости реакции при всех концентрациях участвующих веществ равных единице.
Коэффициент диффузии – численно равен скорости адсорбации при разности концентраций в объеме и в зоне реакции равной 1 моль/л, площади поверхности адсорбации 1 м2 и при прохождении через единицу толщины пограничного диффузионного слоя равной 1м; завсисит от природы адсорбируемого вещества, адсорбента и температуры.
Лимитирующая стадия – стадия многостадийной химической реакции, от которой зависит скорость всей реакции.
Межфазная энергия – поверхностная энергия, обусловленная нескомпенсированностью полей частиц на границе раздела фаз: жидкость – жидкость.
Молекулярность химической реакции – число молекул реагента, принимающих участие в простейшей (элементарной) стадии.
Необратимые химические реакции – реакции, протекающие в одном напрвлении.
Обратимые химические реакции – реакции, протекающие в прямом и обратном направлении.
Общий порядок химической реакции(n) – сумма порядков реакции по реагентам в кинетическом уравнении.
Объект термодинамического исследования – объект, выделенный из окружающего мира, реально или условно отделенный поверхностями раздела.
Открытые системы – системы, которые обмениваются с окружающей средой веществом и энергией.
Период полураспада (t1/2) – равен времени, в течение которого концентрация реагента уменьшается вдвое по сравнению с начальной концентрацией.
Поверхностная энергия – энергия Гиббса образования единицы поверхности.
Поверхностно-активные вещества – адсорбирующиеся вещества, которые могут понижать поверхностное натяжение.
Поверхностное натяжение – поверхностная энергия, обусловленная нескомпенсированностью полей на границе раздела фаз: жидкость – газ.
Порядок химической реакции по данному веществу – показатель степени при концентрации данного вещества в кинетическом уравнении.
Простые реакции – реакции, протекающие в одну стадию.
Процесс в термодинамике – это не развитие события во времени, а последовательность равновесных состояний системы, ведущих от начального набора термодинамических переменных к конечному.
Радикальные реакции – реакции, в которых во взаимодействие вступают радикалы с неспаренными электронами: -ОН, - NH, - СН3.
Реакции второго порядка – реакции, для которых порядок реакции равен двум и описываются кинетическим уравнением: C=C0/(1+ k C0τ).
Реакции нулевого порядка – реакции, скорость которых не зависит от концентрации реагентов в растворе, описываются кинетическим уравнением: 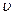 =
= 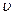 0- k τ.
0- k τ.
Реакции первого порядка – реакции, для которых порядок реакции равен единице и описывается кинетическим уравнением: 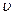 = k C0C- k τ.
= k C0C- k τ.
Селективность действия катализатора – явление катализа, в результате которого продукты реакции могут быть различными в зависимости от того, какой катализатор используется.
Скорость химической реакции – число элементарных актов химических превращений, приводящих к образованию продуктов реакции в единицу времени в единице обьема или на единице поверхности (равна изменению количества вещества в единице реакционного пространства).
Сложные реакции – реакции, протекающие в несколько стадий.
Сопряженные реакции – реакции, в которых с одним и тем же веществом реагируют два или более веществ.
Стерический фактор – коэффициент «А» в уравнении Аррениуса, определяющий вероятность активного столкновения.
Тепловой эффект – изменение энергии системы при протекании в ней химической реакции при условии, что система не совершает никакой другой работы, кроме работы расширения; количество выделенной или поглощенной теплоты в ходе химической реакции.
Теплота образования из атомов – это изменение энтальпии при образовании вещества из газообразных атомов, равна суммарной энергии химических связей в веществе.
Термохимические уравнения – химические уравнения процессов, в которых указаны тепловые эффекты и агрегатные состояния веществ.
Удельная площадь поверхности адсорбции – площадь адсорбента, отнесенная к единице объема или массы вещества.
Удельная скорость реакции – скорость реакции, отнесенная к единице поверхности.
Фазовая диаграмма – диаграмма, по которой можно определить условия устойчивости фаз и фазового равновесия.
Фазовое равновесие – равновесие перехода вещества из одной фазы в другую без изменения химического состава.
Физическая адсорбция - адсорбция, при которой возникают ван-дер-ваальсовы взаимодействия; характеризуется относительно невысоким тепловым эффектом и обратимостью.
Фотохимические реакции – процессы, протекающие под воздействием света.
Характеристические функции состояния – это такие термодинамические функции, значение которых зависит только от начального и конечного состояния системы и не зависит от путей перехода между ними.
Хемосорбция – процесс поглащения при которой возникают химические связи, протекает необратимо, тепловой эффект близок к тепловому эффекту химических реакций.
Химическая кинетика – наука о химическом процессе, его механизме и закономерности протекания во времени, изучает скорости химических реакций и зависимость скорости от условий протекания процесса.
Химическая термодинамика – наука, изучающая энергетические эффекты, сопровождающие физические и химические процессы, а также условия их самопроизвольного протекания.
Цепные реакции – реакции, для которых один первичный акт активации приводит к превращению огромного числа молекул, частиц.
Экзотермический процесс – реакция, протекающая с выделением теплоты, т. е. с понижением энтальпии системы.
Эндотермический процесс – реакция, протекающая с поглощением теплоты, т.е. с повышением энтальпии системы.
Энергия активации – избыточная энергия, необходимая для перехода вещества в состояние активированного комплекса.
Энергия Гельмгольца(F) – характеризует направление и предел самопроизвольного течения химической реакции при проведении процесса в изохорно-изотермических условиях, которое возможно при соблюдении неравенства ΔF<0; F=ΔU – TΔS.
Энергия Гиббса – часть энергетического эффекта химической реакции, которую можно превратить в работу (кроме работы сил расширения).
Энергия кристаллической решетки – энергия, которую нужно затратить, чтобы разорвать связи кристаллической решетки и превратить ионы в газообразные ионы.
Энтальпийная диаграмма – это графическое изображениеразличий в уровнях энтальпий исходных, промежуточных и конечных продуктов.
Энтальпия – термодинамическаяфункция состояния, приращение которой равно теплоте, полученной системой в изобарическом процессе, DН = -Q
Энтропия – термодинамическая функция, которая служит мерой неупорядочности состояния системы, равна минимальной теплоте, подводимой к системе в изотермическом обратимом процессе, деленная на абсолютную температуру S=Qmin/T.
ПРИЛОЖЕНИЕ Б
Тесты по теме химическая кинетика и термодинамика
1. В результате каких процессов внутренняя энергия системы увеличивается? Какой знак будет иметь работа W, если Q=0?
а) адиабатические, W<0; б) изохорические, W<0;
в) изобарические, W>0; г) изотермический, W<0
2. Как изменяется энтропия при растворении в воде СО2 (1) и Na2SO4 (2)?
а) (1) – уменьшается, (2) - увеличивается
б) (1), (2) – уменьшается;
в) (1) – увеличивается, (2) – уменьшается./
г) (1) – увеличиться, (2) - увеличивается
3. При растворении NH4 NO3 в воде температура системы понизилась на несколько градусов. Является ли этот процесс эндотермическим или экзотермическим? Какой знак имеет изменение энтальпии данного процесса?
a) Экзотермический, ΔН<0 г) Экзотермический, ΔН>0
б) Эндотермический, ΔΗ>0 д) Эндотермический, ΔΗ=0
в) Эндотермический, ΔН<0
4. Определите знак энтропии реакции, протекающей в нейтрализаторах автомобилей (дожигателей СО): СО+1/2 О2 =СО2,без проведения расчета.
а) ΔS<0 б) ΔS>0 в) ΔS=0 г) ΔS<=0 д) ΔS>=0
5. Увеличивается ли внутренняя энергия системы, если Q=0 и W=0? Поясните
а) увеличивается. б) уменьшается
в) не изменяется г) равна нулю
6. Скорость гетерогенной химической реакции зависит:
а) от концентрации жидких и газообразных исходных веществ, температуры, катализатора.
б) от концентрации жидких и газообразных исходных веществ, температуры, поверхности раздела фаз, катализатора.
в) от поверхности раздела фаз, от температуры, не зависит от концентрации.
г) от концентрации твердых веществ, температуры, поверхности раздела.
д) от температуры, от поверхности раздела
7. Порядок химических реакций:
а) совпадает во всех случаях со стехиометрическими коэффициентами химических уравнений.
б) не совпадает.
в) совпадает в редких случаях.
г) не зависит от стехиометрических коэффициентов.
8.Скорость реакций первого порядка описывается уравнением:
а) υ = kc2; б) υ = kc0 e-kt; в) υ = υ0 – kt; г) υ = kc3
9. Третий закон термодинамики:
а) энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле равна нулю;
б) в изолированных системах самопроизвольно идут только такие процессы, которые сопровождаются возрастанием энтропии;
в) в изолированной системе общее количество энергии постоянно;
г) изменение энтальпии кругового процесса равно нулю;
10. Катализатор – это…
а) вещество ускоряющее реакцию и не участвующее в ней;
б) вещество, ускоряющее химическую реакцию, но не испытывающие химического превращения в результате;
в) вещество, замедляющее протекание химической реакции;
г) вещество не влияющее на скорость химической реакции
11. Математическое выражение закона действующих масс:
а) Kc = Kp(RT)∆υ; б) Kc = [D]d ∙ [F]f / [A]a[B]b;
в) ∆G0 = -RTlnK; г) u = [A]a[B]b.
12. Математическая запись первого закона термодинамики:
а) H = U + pV; б) S = RlnW;
в) Q = ∆U + p∆V; г) F= U+TS;
д) ∆G= -RTlnK.
13. Условием самопроизвольного протекания процесса является:
а) ∆G = 0; б) ∆G < 0; в) ∆G > 0; г) ∆S> 0; д)) ∆H< 0.
14. Математическое выражение для уравнения Нернста:
а) ∆G = ∆G° + RT ln [B]b / [A]a; б) Е = Е0 + RT/nF ln (аох/аrod).
в) Kc = [D]d ∙ [F]f / [A]a[B]b; г) ∆G0 = -RTlnK.
15. Кинетическое уравнение для гетерогенных химических реакций имеет вид:
а) υ = kCA∙ CB; б) υ = kC0e-kJ; в) υ = k ∙ C ∙ S; г) υ = υ0 – kt;
16. Выберете выражение для константы равновесия системы: 2A+B = C, если А и С газы, В – твердое вещество:
а) К = [С] / [А] ∙ [В]; б) К = [С] / [А]2;
в) К = [С] / [А]2 ∙ [В]; г) Kc = Kp(RT)∆υ
17. Укажите правильную формулировку нулевого закона термодинамики:
а) две системы, находящиеся в термическом равновесии с третьей системой, состоят в термическом равновесии друг с другом;
б) тепловой эффект обратной реакции равен тепловому эффекту прямой, но с обратным знаком;
в) энергия не создается, не уничтожается;
г) изменение энтальпии кругового процесса равно нулю.
18. Лимитирующая стадия химической реакции – это:
а) самая быстрая стадия многостадийной реакции;
б) самая медленная стадия многостадийной реакции;
в) стадия, от которой зависит скорость всей сложной реакции;
г) самая медленная стадия параллельной реакции.
19. При окислении одного моля SO2 до SO3 выделяется 98 КДж
теплоты. Запишите термодинамическое уравнение этой реакции:
а) 2SO2(г) + O2(г) → 2SO3(г) ∆H = -98 КДж;
б) SO2(г) + 1/2O2(г) → SO3(г) ∆H = -98 КДж;
в) SO2(г) + 1/2O2(г) → SO3(г) ∆H = 98 КДж;
г) SO2 + 1/2O2 → SO3
20. Определите энергию активации реакции, константа скорости которой увеличилась в 105 раз при повышении температуры с 330 до 400 К.
а) 191 КДж; б) 291 КДж; в) 91 КДж; г) 390 КДж.
Date: 2015-10-19; view: 599; Нарушение авторских прав