
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическое равновесие. Все химические реакции можно разбить на две группы: необратимые и обратимые реакции
|
|
Все химические реакции можно разбить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца — до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что необратимая реакция может протекать только в одном направлении. Обратимая же реакция может протекать как в прямом, так и в обратном направлениях.
Рассмотрим два примера.
Пример 1. Взаимодействие между цинком и концентрированной азотной кислотой протекает согласно уравнению:
Zn + 4HNO3 = Zn(NO3)2 + 2NO2 + 2H2O
При достаточном количестве азотной кислоты реакция закончится только тогда, когда весь цинк растворится. Кроме того, если попытаться провести эту реакцию в обратном направлении — пропускать диоксид азота через раствор нитрата цинка, то металлического цинка и азотной кислоты не получится — данная реакция не может протекать в обратном направлении. Таким образом, взаимодействие цинка с азотной кислотой — необратимая реакция.
Пример 2. Синтез аммиака протекает согласно уравнению:
N2+ 3H2 = 2NH3
Если смешать один моль азота с тремя молями водорода, осуществить в системе условия, благоприятствующие протеканию реакции, и по истечении достаточного времени произвести анализ газовой смеси, то результаты анализа покажут, что в системе будет присутствовать не только продукт реакции (аммиак), но и исходные вещества (азот и водород). Если теперь в те же условия в качестве исходного вещества поместить не азото-водородную смесь, а аммиак, то можно будет обнаружить, что часть аммиака разложится на азот и водород, причем конечное соотношение между количествами всех трех веществ будет такое же, как в том случае, когда исходили из смеси азота с водородом. Таким образом, синтез аммиака — обратимая реакция.
В уравнениях обратимых реакций вместо знака равенства можно ставить стрелки; они символизируют протекание реакции как в прямом, так и обратном направлениях.
Обратимые реакции - химические реакции, протекающие одновременно в двух противоположных направлениях.

|
Рисунок 5 – Изменение скорости прямой и обратной
химической реакции
Химическое равновесие - состояние системы, в котором скорость прямой реакции (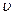 1) равна скорости обратной реакции (
1) равна скорости обратной реакции (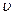 2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (k1) и обратной (k2) реакций.
Для реакции mA + nB pC + dD константа равновесия равна:
K = k1 / k2 = ([C]p • [D]d) / ([A]m • [B]n) (1.24)
Константа равновесия зависит от температуры и природы реагирующих веществ и не зависит от присутствия катализаторов. Поскольку катализатор изменяет энергию активации и прямой, и обратной реакций на одну и ту же величину, то на отношение констант их скорости он не оказывает влияния. Поэтому катализатор не влияет на величину константы равновесия и, следовательно, не может ни увеличить, ни снизить выход реакции. Он может лишь ускорить или замедлить наступление равновесия.
Смысл этого уравнения можно выразить так:
для одной и той же температуры отношение произведений равновесных концентраций (в степенях их стехиометрических коэффициентов) веществ в правой и левой частях уравнения химической реакции представляет постоянную величину.
Не забывать
1) Все это правильно только для равновесных концентраций.
2) Записывая константу, надо помнить, что в числителе стоят равновесные концентрации конечных продуктов, а в знаменателе – начальных веществ.
Что такое К? Константа равновесия показывает глубину протекания процесса. Если К>>1, процесс сильно сдвинут в сторону получения продуктов реакции. Если К<<1, наоборот, процесс сильно сдвинут влево и реакция практически не идет. К = 1 – равновесие установилось «на полдороге».
Следует различать истинное равновесие и мнимое или кажущееся, которое называют еще заторможенным равновесием или метастабильным состоянием. (В колбе водород, кислород и вода – ничего не меняется годами, чтобы понять, что это не равновесие, поднесите спичку).
Условия истинного равновесия:
1) при сохранении внешних условий состояние системы не меняется во времени;
2) при изменении условий (введение дополнительных количеств реагирующих веществ, изменение давления или температуры) система приходит к новому состоянию равновесия;
3) к состоянию равновесия можно подойти с противоположных сторон.
Равновесное состояние системы H2 + I2 ó2HI может быть достигнуто исходя из водорода и иода, а можно получить то же самое, взяв HI.
Для равновесий между газообразными веществами удобно пользоваться не молярными концентрациями, а парциальными давлениями. Константа равновесия, выраженная через молярные концентрации – Кс, а через парциальные давления – Кр. Связь между Кс и Кр.
Кс = Кр(RT)D, (1.25)
где D - разность числа молей исходных веществ и конечных
продуктов.
Способы смещения равновесия
Принцип Ле-Шателье. Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие
1. Давление. Увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к уменьшению объема (т.е. к образованию меньшего числа молекул).
2. Увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплоты)
3. Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещает равновесие в сторону прямой реакции.
4. Катализаторы не влияют на положение равновесия.
Date: 2015-10-19; view: 379; Нарушение авторских прав