
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическое равновесие. Необратимые и обратимые реакции
|
|
Необратимые и обратимые реакции. Необратимые реакции протекают до конца – до полного израсходования одного из реагирующих веществ, то есть в одном направлении. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что обратимая же реакция может протекать как в прямом, так и в обратном направлениях. Например:
Взаимодействие между цинком и концентрированной азотной кислотой протекает согласно уравнению и является необратимым:
Zn + 4HNО3 = Zn(NО3)2 + 2NO2 + 2H2O
Синтез аммиака является обратимой реакцией и протекает согласно уравнению: N2 + ЗН2 ® 2NH3.
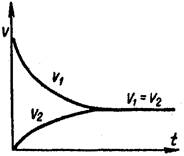
Химическое равновесие называют динамическим равновесием. При равновесии протекают и прямая, и обратная реакции, но их скорости одинаковы, вследствие чего изменений в системе не наблюдается.
Количественной характеристикой химического равновесия служит константа химического равновесия. Рассмотрим ее на примере реакции синтеза йодистого водорода:

 Н2 + I2 2НI
Н2 + I2 2НI
Согласно закону действия масс, скорости прямой (V1) и обратной (V2) реакций выражаются уравнениями:
V1 = k1[H2][I2]; V2 = k2[HI]2
При равновесии скорости прямой и обратной реакций равны друг другу, откуда
V1 = V2; k1[H2][I2] = k2[HI]2
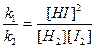
Отношение констант скорости прямой и обратной реакций тоже представляет собой константу. Она называется константой равновесия данной реакции (К):
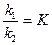
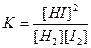
В левой части этого уравнения стоят равновесные концентрации. Правая же часть уравнения представляет собой постоянную (при постоянной температуре) величину. Можно показать, что в общем случае обратимой реакции
аА + bВ +... «pP + qQ +...
константа равновесия выразится уравнением:

В условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собою. Изменение концентрации любого из этих веществ влечет за собою изменения концентраций всех остальных веществ; в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
Численное значение константы равновесия в первом приближении характеризует выход данной реакции. (Выходом реакции называется отношение количества получаемого вещества к тому его количеству, которое получилось бы при протекании реакции до конца.) Например, при К >>1 выход реакции велик, потому что при этом
[P]p[Q]q…>> [A]a[B]b…
т.е. при равновесии концентрации продуктов реакции много больше концентраций исходных веществ, а это и означает, что выход реакции велик. При К. << 1 (по аналогичной причине) выход реакции мал.
В случае гетерогенных реакций в выражение константы равновесия, так же как и в выражение закона действия масс, входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Например, для реакции
СО2 + С = 2СО 
Величина константы равновесия зависит от природы реагирующих веществ и от температуры.
Связь константы равновесия с энергией Гиббса даётся уравнением:
ΔG = - RT´ln Kp (кДж/моль).
Если Кр >1 (k1>k2), то равновесие смещено вправо, и ΔG<0;
если же Кр <1 (k1<k2), то равновесие смещено влево, и ΔG<0.
Date: 2015-10-22; view: 630; Нарушение авторских прав